Precose 25mg, 50mg Acarbose 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Precose 50mgとは何ですか?
Precose (アカルボース錠) は、2 型糖尿病の治療に使用される経口 α-グルコシダーゼ阻害剤です。 Precose 50mg は、経口摂取するインスリンや他の糖尿病薬と組み合わせて使用されることがあります。 Precose 25mg は一般的な形で入手できます。
Precose 25mgの副作用は何ですか?
Precose の一般的な副作用は次のとおりです。
- 下痢、
- ガス、
- 膨満感、
- 胃のむかつき、または
- あなたの体がこの薬に順応するにつれて、治療の最初の数週間で胃の痛みがありますが、通常は時間とともに改善します.
Precose 50mg のその他の副作用には、皮膚の発疹やかゆみがあります。 Precose 25mg の次のようなまれではあるが非常に深刻な副作用がある場合は、医師に相談してください。
- 異常な疲労感
- 持続的な吐き気や嘔吐、
- 激しい胃や腹痛、
- 直腸出血、
- 目や皮膚の黄変、または
- 暗い尿。
説明
PRECOSE® (アカルボース錠) は、2 型糖尿病の管理に使用する経口α-グルコシダーゼ阻害剤です。アカルボースは、微生物 Actinoplanes utahensis の発酵過程で得られるオリゴ糖で、化学的には O-4,6-dideoxy4-[[(1S,4R,5S,6S)-4,5,6-trihydroxy- 3-(ヒドロキシメチル)-2-シクロヘキセン-1-イル]アミノ] α-D-グルコピラノイル-(1 → 4)-O-α-D-グルコピラノシル-(1 →4)-D-グルコース。これは、分子量 645.6 の白色からオフホワイトの粉末です。アカルボースは水に溶け、pKa は 5.1 です。その実験式は C25H43NO18 であり、その化学構造は次のとおりです。
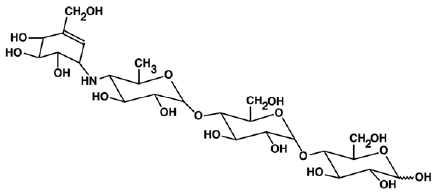
プリコース 50mg は、経口用に 25mg、50mg、および 100mg の錠剤として入手できます。不活性成分は、デンプン、微結晶性セルロース、ステアリン酸マグネシウム、およびコロイド状二酸化ケイ素です。
適応症
PRECOSE は、2 型糖尿病の成人の血糖コントロールを改善するための食事と運動の補助として適応されます。
投薬と管理
PRECOSE やその他の薬理学的薬剤による糖尿病の管理のための決まった投薬計画はありません。 PRECOSE 25 mg の投与量は、有効性と耐性の両方に基づいて個別化する必要がありますが、最大推奨用量の 100 mg を超えないようにする必要があります。
PRECOSE は、胃腸の副作用を軽減し、患者の適切な血糖コントロールに必要な最小用量を特定できるようにするために、低用量で開始し、以下に説明するように徐々に用量を増やしてください。規定の食事を守らないと、腸の副作用が強まる可能性があります。処方された糖尿病食を順守しているにも関わらず、非常に苦痛な症状が現れた場合は、医師に相談し、用量を一時的または永久的に減らす必要があります。
治療開始および用量漸増(下記参照)中、食後1時間の血漿グルコースを使用して、PRECOSEに対する治療反応を決定し、患者の最小有効用量を特定することができます。その後、糖化ヘモグロビンを約 3 ヶ月間隔で測定する必要があります。治療目標は、単独療法として、またはスルホニル尿素、インスリン、またはメトホルミンと組み合わせて、PRECOSEの最小有効用量を使用することにより、食後の血漿グルコースおよびグリコシル化ヘモグロビンレベルの両方を正常またはほぼ正常に低下させることです.
初回投与量
プリコース 25mg の推奨開始用量は、1 日 3 回、各主食の開始時 (最初の一口) に 25mg を経口投与することです。ただし、一部の患者は、胃腸の副作用を最小限に抑えるために、より段階的な用量漸増が有効な場合があります。これは、1 日 1 回 25 mg で治療を開始し、その後投与頻度を増やして 25 mg tid を達成することで達成できます。
維持投与量
日 25 mg の投与計画に達したら、食後 1 時間のグルコースまたはグリコシル化ヘモグロビンのレベル、および耐性に基づいて、4 ~ 8 週間間隔で PRECOSE 50 mg の投与量を調整する必要があります。投与量は、25 mg tid から 50 mg tid に増やすことができます。一部の患者は、さらに 100 mg tid に投与量を増やすことで効果が得られる場合があります。維持量は、50 mg tid から 100 mg tid の範囲です。血清トランスアミナーゼ上昇のリスクがあるため、体重が 60 kg を超える患者のみが 50 mg tid を超える用量設定を考慮すべきです ( 予防 )。食後のグルコースまたはグリコシル化ヘモグロビンのレベルが 100 mg tid に漸増してもそれ以上の低下が観察されない場合は、用量を下げることを検討する必要があります。効果的で許容される投与量が確立されたら、それを維持する必要があります。
最大投与量
60 kg 以下の患者の最大推奨用量は 50 mg 1 日 3 回 60 kg を超える患者の最大推奨用量は 100 mg 1 日 3 回
スルホニル尿素薬またはインスリンを投与されている患者
スルホニル尿素剤またはインスリンは低血糖を引き起こす可能性があります。スルホニル尿素またはインスリンと組み合わせて投与される PRECOSE は、血糖値をさらに低下させ、低血糖の可能性を高める可能性があります。低血糖が発生した場合は、これらの薬剤の投与量を適切に調整する必要があります。
供給方法
PRECOSE は、25 mg、50 mg、または 100 mg の丸型の無分割錠として入手できます。各錠剤の強度は、白色から黄色がかった色です。 25 mg の錠剤は、片面に「PRECOSE」、もう片面に「25」という言葉でコード化されています。 50 mg の錠剤は、同じ面に「PRECOSE」と「50」という言葉でコード化されています。 100 mg 錠は、同じ面に「PRECOSE」と「100」という言葉でコード化されています。 PRECOSE は、100 の単位用量パッケージで 100 および 50 mg の強度のボトルで入手できます。
25°C (77°F) 以上で保管しないでください。湿気から保護してください。ボトルの場合は、容器をしっかりと閉めてください。
Bayer HealthCare Pharmaceuticals Inc. Wayne, NJ 07470. ドイツ製。 11/11
副作用
消化管
PRECOSEに対する最も一般的な反応は胃腸症状です。米国のプラセボ対照試験では、PRECOSE 50~300 mg tid で治療された 1,255 人の患者の腹痛、下痢、および鼓腸の発生率はそれぞれ 19%、31%、および 74% であり、対応する発生率は 9%、12% でした。 、999 人のプラセボ治療患者で 29% でした。
患者が胃腸症状の日記を付けた1年間の安全性研究では、腹痛と下痢は時間の経過とともに治療前のレベルに戻る傾向があり、鼓腸の頻度と強度は時間とともに弱まる傾向がありました. PRECOSE 50mgで治療された患者の胃腸管症状の増加は、PRECOSEの作用機序の現れであり、下部消化管の未消化炭水化物の存在に関連しています.
規定の食事を守らないと、腸の副作用が強まる可能性があります。処方された糖尿病食を順守しているにも関わらず、非常に苦痛な症状が現れた場合は、医師に相談し、用量を一時的または永久的に減らす必要があります。
血清トランスアミナーゼ値の上昇
見る 予防 .
その他の検査所見の異常
ヘマトクリットのわずかな減少は、プラセボ治療を受けた患者よりも PRECOSE 治療を受けた患者の方が頻繁に発生しましたが、ヘモグロビンの減少とは関連していませんでした。低血清カルシウムおよび低血漿ビタミン B6 レベルは、PRECOSE 50mg 療法と関連していましたが、偽物であるか、臨床的意義がないと考えられています。
市販後有害事象報告
世界的な市販後の経験から報告された追加の有害事象には、致命的な結果を伴う劇症肝炎、過敏性皮膚反応(発疹、紅斑、発疹および蕁麻疹など)、浮腫、イレウス/亜イレウス、黄疸および/または肝炎および関連する肝障害、血小板減少症、および肺炎が含まれます。シストイド・インテスティナリス(を参照) 予防 )。
気腫症 Cystoides Intestinalis
Precose を含む α-グルコシダーゼ阻害剤の使用に関連した腸管嚢胞性気腫のまれな市販後の報告がありました。 Pneumatosis cystoides intestinalis は、下痢、粘液分泌物、直腸出血、および便秘の症状を呈することがあります。合併症には、気腹、腸捻転、腸閉塞、腸重積、腸出血、および腸穿孔が含まれる場合があります。腸管嚢胞性気腫が疑われる場合は、プレコース 25mg を中止し、適切な画像診断を行ってください。
薬物相互作用
特定の薬は高血糖を引き起こす傾向があり、血糖コントロールの喪失につながる可能性があります.これらの薬物には、チアジドおよびその他の利尿薬、コルチコステロイド、フェノチアジン、甲状腺製品、エストロゲン、経口避妊薬、フェニトイン、ニコチン酸、交感神経刺激薬、カルシウムチャネル遮断薬、およびイソニアジドが含まれます。 PRECOSE 25mgを服用している患者にこれらの薬剤を投与する場合は、患者の血糖コントロールが失われていないか注意深く観察する必要があります。 PRECOSE 50mg をスルホニル尿素またはインスリンと組み合わせて投与されている患者からそのような薬剤を中止する場合、患者は低血糖の徴候がないか注意深く観察する必要があります。
スルホニル尿素薬またはインスリンを投与されている患者: スルホニル尿素薬またはインスリンは低血糖を引き起こす可能性があります。 PRECOSE 25mg をスルホニル尿素またはインスリンと組み合わせて投与すると、血糖値がさらに低下し、低血糖の可能性が高まる可能性があります。低血糖が発生した場合は、これらの薬剤の投与量を適切に調整する必要があります。ごくまれに、スルホニル尿素および/またはインスリンと組み合わせた PRECOSE 療法を受けている患者で、低血糖ショックの個々の症例が報告されています。
腸内吸着剤(木炭など)や炭水化物分解酵素(アミラーゼ、パンクレアチンなど)を含む消化酵素製剤は、PRECOSEの効果を低下させる可能性があるため、併用しないでください。
PRECOSE 25mg は、ジゴキシンを併用投与すると、ジゴキシンのバイオアベイラビリティを変化させることが示されており、ジゴキシンの用量調整が必要になる場合があります。 (見る 臨床薬理学 、 薬物間相互作用 .)
警告
情報が提供されていません
予防
全般的
大血管転帰
PRECOSE 25mgまたはその他の抗糖尿病薬による大血管リスクの減少の決定的な証拠を確立する臨床研究はありません.
低血糖症
その作用機序により、PRECOSE を単独で投与した場合、空腹時または食後の状態で低血糖を引き起こすことはありません。スルホニル尿素剤またはインスリンは低血糖を引き起こす可能性があります。 PRECOSE 50mg をスルホニル尿素またはインスリンと組み合わせて投与すると、血糖値がさらに低下するため、低血糖の可能性が高くなる可能性があります。通常の使用状況下でメトホルミンのみを投与された患者では低血糖は発生せず、メトホルミン療法にプリコース50mgを追加した患者で低血糖の発生率の増加は観察されませんでした.
軽度から中等度の低血糖症の治療では、スクロース(サトウキビ糖)の代わりに、吸収が PRECOSE によって阻害されない経口ブドウ糖(デキストロース)を使用する必要があります。グルコースとフルクトースへの加水分解が PRECOSE によって阻害されるスクロースは、低血糖の迅速な修正には適していません。重度の低血糖症では、ブドウ糖の静脈内注入またはグルカゴン注射のいずれかが必要になる場合があります。
血清トランスアミナーゼ値の上昇
米国で実施された長期研究(最大 12 か月、1 日 300 mg までの PRECOSE 25 mg の投与を含む)では、血清トランスアミナーゼ(AST および/または ALT)が正常上限(ULN )、ULN の 1.8 倍以上、および ULN の 3 倍以上が、それぞれ 7%、2%、および 1% と比較して、PRECOSE 治療を受けた患者の 14%、6%、および 3% で発生しました。プラセボ治療を受けた患者の。治療間のこれらの差は統計的に有意でしたが、これらの上昇は無症候性で可逆的であり、女性でより一般的であり、一般的に、肝機能障害の他の証拠とは関連していませんでした.さらに、これらの血清トランスアミナーゼの上昇は、用量に関連しているように見えました。 PRECOSE 50mg の最大承認用量 100mg tid までを含む米国の研究では、あらゆる重症度レベルでの AST および/または ALT の治療による上昇は、PRECOSE で治療された患者とプラセボで治療された患者の間で類似していました (p ≥ 0.496)。 .
PRECOSE 50mg の約 300 万患者年にわたる国際的な市販後経験において、500 IU/L を超える血清トランスアミナーゼ上昇の 62 例 (そのうち 29 例は黄疸に関連していた) が報告されています。これらの 62 人の患者のうち 41 人が 100 mg 1 日 3 回以上の治療を受け、体重が報告された 45 人の患者のうち 33 人の体重が 60 kg 未満でした。経過観察が記録された 59 例では、55 例で PRECOSE の中止により肝異常が改善または解消し、2 例で不変でした。致命的な結果を伴う劇症肝炎の症例が報告されています。アカルボースとの関係は不明です。
血糖コントロールの喪失
糖尿病患者が発熱、外傷、感染症、手術などのストレスにさらされると、一時的に血糖値の制御が失われることがあります。このような場合、一時的なインスリン療法が必要になることがあります。
臨床検査
PRECOSE に対する治療反応は、定期的な血糖検査によって監視する必要があります。糖化ヘモグロビンレベルの測定は、長期的な血糖コントロールのモニタリングに推奨されます。
PRECOSE 25mg、特に 1 日 50mg を超える用量で、血清トランスアミナーゼの上昇を引き起こし、まれに高ビリルビン血症を引き起こす可能性があります。 PRECOSE による治療の最初の 1 年間は 3 か月ごとに血清トランスアミナーゼ レベルをチェックし、その後は定期的にチェックすることをお勧めします。トランスアミナーゼの上昇が観察された場合、特に上昇が持続する場合は、投与量の削減または治療の中止が必要になる場合があります。
腎障害
腎障害のあるボランティアにおける PRECOSE の血漿中濃度は、腎機能障害の程度に比例して増加しました。重大な腎機能障害 (血清クレアチニン > 2.0 mg/dL) を有する糖尿病患者における長期臨床試験は実施されていません。したがって、これらの患者の PRECOSE 50mg による治療は推奨されません。
発がん、突然変異誘発、および生殖能力の障害
アカルボースを用いた8件の発がん性試験が実施されました。 6 つの研究がラット (2 つの系統、Sprague-Dawley と Wistar) で実施され、2 つの研究がハムスターで実施されました。
最初のラット研究では、Sprague-Dawley ラットに 104 週間、高用量 (最大約 500 mg/kg 体重) のアカルボースを飼料で与えました。アカルボース治療により、腎腫瘍(腺腫および腺癌)および良性ライディッヒ細胞腫瘍の発生率が大幅に増加しました。この研究は繰り返され、同様の結果が得られました。アカルボースの直接的な発がん作用と、研究で使用された大量のアカルボースによって誘発された炭水化物栄養失調に起因する間接的な作用を分離するために、さらなる研究が行われました。 Sprague-Dawley ラットを使用した 1 つの研究では、アカルボースが飼料と混合されましたが、食事にブドウ糖を追加することで炭水化物の欠乏が防止されました。

Sprague-Dawley ラットの 26 か月間の研究では、薬の薬理学的効果を避けるために、アカルボースを毎日食後に強制経口投与しました。これらの研究の両方で、元の研究で見つかった腎腫瘍の発生率の増加は発生しませんでした。アカルボースは、Wistar ラットでの 2 つの別々の研究でも、食物と食後の強制経口投与によって与えられました。これらの Wistar ラットの研究のいずれにおいても、腎腫瘍の発生率の増加は見られませんでした。ハムスターの 2 つの給餌研究では、ブドウ糖補給の有無にかかわらず、発がん性の証拠もありませんでした。
アカルボースは、CHO 染色体異常アッセイ、細菌変異誘発 (Ames) アッセイ、または DNA 結合アッセイにおいて、in vitro で DNA 損傷を誘発しませんでした。 In vivo では、雄マウスの優性致死試験またはマウス小核試験で DNA 損傷は検出されませんでした。
経口投与後にラットで行われた受精率の研究では、受精率または全体的な生殖能力に悪影響はありませんでした。
妊娠
催奇形性効果: 妊娠カテゴリー B.
妊婦に対するプリコースの安全性は確立されていません。繁殖研究は、最大 480 mg/kg の用量でラットで実施されており (薬物の血中濃度に基づくと、ヒトでの曝露の 9 倍に相当)、アカルボースによる生殖能力の障害または胎児への害の証拠は明らかにされていません。ウサギでは、おそらく腸内での高用量のアカルボースの薬力学的活性の結果である母体の体重増加の減少が、胚の喪失数のわずかな増加の原因である可能性があります。しかし、160 mg/kg のアカルボース (体表面積に基づいてヒトの用量の 10 倍に相当) を与えられたウサギは、胚毒性の証拠を示さず、ヒトの用量の 32 倍の用量 (体表面積に基づく) で催奇形性の証拠もありませんでした。表面積)。しかし、妊娠中の女性を対象とした PRECOSE 25mg の十分に管理された研究はありません。動物の繁殖研究は常に人間の反応を予測できるとは限らないため、この薬は明らかに必要な場合にのみ妊娠中に使用する必要があります.現在の情報は、妊娠中の異常な血糖値が先天性異常の発生率の増加、新生児の罹患率および死亡率の増加と関連していることを強く示唆しているため、ほとんどの専門家は、妊娠中にインスリンを使用して血糖値をできるだけ正常に近づけることを推奨しています。 .
授乳中の母親
放射性標識アカルボースの投与後、授乳中のラットの乳汁に少量の放射能が検出されました。この薬が母乳中に排泄されるかどうかは不明です。多くの薬物は母乳中に排泄されるため、プリコース 25mg は授乳中の女性には投与しないでください。
小児用
小児患者におけるPRECOSE 25mgの安全性と有効性は確立されていません。
高齢者の使用
米国におけるプリコース25mgの臨床試験の全被験者数のうち、27%が65歳以上、4%が75歳以上でした。これらの被験者と若い被験者の間で、安全性と有効性の全体的な違いは観察されませんでした。平均定常状態曲線下面積 (AUC) とアカルボースの最大濃度は、若いボランティアと比較して高齢者で約 1.5 倍高かった。ただし、これらの違いは統計的に有意ではありませんでした。
過剰摂取
スルホニル尿素やインスリンとは異なり、プリコースの過剰摂取は低血糖を引き起こしません。過剰摂取すると、鼓腸、下痢、および腹部の不快感が一時的に増加する可能性がありますが、すぐに治まります.過剰摂取の場合、次の 4 ~ 6 時間は患者に炭水化物 (多糖類、オリゴ糖、二糖類) を含む飲み物や食事を与えないでください。
禁忌
PRECOSE 25mg は、薬物に対する既知の過敏症のある患者には禁忌です。 Precose 25mg は、糖尿病性ケトアシドーシスまたは肝硬変の患者には禁忌です。 PRECOSE 25mg は、炎症性腸疾患、結腸潰瘍、部分的な腸閉塞の患者、または腸閉塞の素因がある患者にも禁忌です。さらに、PRECOSEは、消化または吸収の著しい障害を伴う慢性腸疾患を有する患者、および腸内のガス形成の増加の結果として悪化する可能性のある状態を有する患者には禁忌です.
臨床薬理学
アカルボースは、摂取した炭水化物の消化を遅らせる複雑なオリゴ糖であり、その結果、食事後の血糖値の上昇が小さくなります。血漿グルコース減少の結果として、PRECOSE は 2 型糖尿病患者のグリコシル化ヘモグロビンのレベルを低下させます。グリコシル化ヘモグロビンのレベルによって反映される全身の非酵素的タンパク質グリコシル化は、経時的な平均血糖濃度の関数です。
作用機序
スルホニル尿素とは対照的に、プリコース 50mg はインスリン分泌を増強しません。アカルボースの抗高血糖作用は、膵臓のα-アミラーゼおよび膜結合腸のα-グルコシド加水分解酵素の競合的で可逆的な阻害に起因します。膵臓α-アミラーゼは、小腸の内腔で複雑なデンプンをオリゴ糖に加水分解しますが、膜結合腸α-グルコシダーゼは、小腸の刷子縁でオリゴ糖、三糖、および二糖をグルコースおよび他の単糖に加水分解します。糖尿病患者では、この酵素阻害により、グルコース吸収が遅延し、食後の高血糖が低下します。
作用機序が異なるため、プリコースの血糖コントロールを高める効果は、併用するとスルホニル尿素、インスリン、メトホルミンの効果に加算されます。さらに、プリコース 50mg は、スルホニル尿素のインスリン分泌促進効果と体重増加効果を減少させます。
アカルボースはラクターゼに対する阻害活性を持たないため、乳糖不耐症を誘発することは期待されません。
薬物動態
吸収
人の健康な男性の研究では、アカルボースの経口投与量の 2% 未満が活性薬物として吸収されましたが、14C 標識経口投与量からの総放射能の約 35% が吸収されました。摂取後 96 時間以内に、経口投与量の平均 51% が吸収されない薬物関連放射能として糞便中に排泄されました。アカルボースは胃腸管内で局所的に作用するため、親化合物のこの低い全身生物学的利用能は治療上望ましい。健康な志願者に 14C 標識アカルボースを経口投与した後、投与後 14 ~ 24 時間で放射能のピーク血漿濃度に達し、活性薬物のピーク血漿濃度は約 1 時間で達成されました。アカルボース関連放射能の吸収遅延は、腸内細菌または腸内酵素加水分解のいずれかによって形成される代謝産物の吸収を反映しています。
代謝
アカルボースは、主に腸内細菌だけでなく、消化酵素によっても消化管内でのみ代謝されます。これらの代謝産物の一部 (投与量の約 34%) が吸収され、続いて尿中に排泄されました。少なくとも 13 の代謝物が尿検体からクロマトグラフィーで分離されています。主要な代謝物は、4-メチルピロガロール誘導体 (すなわち、硫酸塩、メチル、およびグルクロニド抱合体) として同定されています。 1 つの代謝産物 (アカルボースからのグルコース分子の切断によって形成される) も、α-グルコシダーゼ阻害活性を持っています。この代謝産物は、尿から回収された親化合物とともに、総投与量の 2% 未満を占めます。
排泄
無傷の薬物として吸収されるアカルボースの一部は、腎臓からほぼ完全に排泄されます。アカルボースを静脈内に投与すると、投与量の 89% が 48 時間以内に活性薬物として尿中に回収されました。対照的に、経口投与量の 2% 未満が活性 (つまり、親化合物および活性代謝物) 薬物として尿中に回収されました。これは、親薬のバイオアベイラビリティが低いことと一致しています。アカルボース活性の血漿排出半減期は、健康なボランティアでは約 2 時間です。したがって、1 日 3 回 (tid) の経口投与では薬物の蓄積は起こりません。
特別な集団
平均定常状態曲線下面積 (AUC) とアカルボースの最大濃度は、若いボランティアと比較して高齢者で約 1.5 倍高かった。ただし、これらの違いは統計的に有意ではありませんでした。重度の腎機能障害 (Clcr
薬物間相互作用
健康なボランティアを対象とした研究では、PRECOSE がニフェジピン、プロプラノロール、またはラニチジンの薬物動態または薬力学に影響を与えないことが示されています。 PRECOSE は、糖尿病患者におけるスルホニル尿素グリブリドの吸収または体内動態を妨げませんでした。 PRECOSE はジゴキシンのバイオアベイラビリティに影響を与える可能性があり、ジゴキシンの用量を 16% (90% 信頼区間: 8-23%) 調整する必要があり、ジゴキシンの平均 Cmax を 26% (90% 信頼区間: 16-34%) 低下させ、平均トラフを減少させます。ジゴキシンの濃度が 9% 低下します (90% 信頼限界: 19% 減少から 2% 増加)。 (見る 予防: 薬物相互作用 .)
血漿 AUC 値で示されるように、PRECOSE の服用中に吸収されたメトホルミンの量は、プラセボの服用時に吸収された量と生物学的に同等でした。ただし、メトホルミンの吸収がわずかに遅れるため、プリコースを服用すると、メトホルミンのピーク血漿レベルが約20%低下しました。 PRECOSE とメトホルミンの間に臨床的に重要な相互作用はほとんどありません。
臨床試験
食事療法のみの 2 型糖尿病患者における用量設定研究からの臨床経験
769 人の PRECOSE 治療を受けた患者を含む、2 型糖尿病の治療における PRECOSE の 6 つの制御固定用量単剤療法研究の結果を組み合わせ、ベースラインからのグリコシル化ヘモグロビンの平均変化におけるプラセボとの差の加重平均を求めました ( HbA1c) は、以下に示すように各用量レベルについて計算されました。
研究では 200 または 300 mg tid の最大用量が使用されましたが、60 kg 未満の患者の最大推奨用量は 50 mg tid です。 60 kg を超える患者の最大推奨用量は、1 日 1 回 100 mg です。
次の図に示すように、これら 6 つの固定用量の単剤療法試験の結果も組み合わせて、食後 1 時間の血漿グルコース値のベースラインからの平均変化におけるプラセボとの差の加重平均を導き出しました。
図1 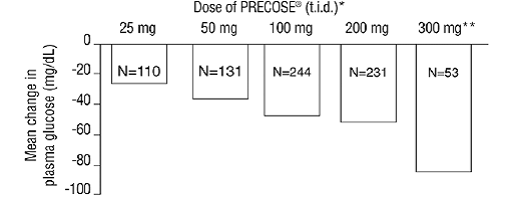
* PRECOSE 50mg は、食後 1 時間の血漿グルコースに対する効果に関して、すべての用量でプラセボと統計的に有意な差がありました。 **300 mg tid PRECOSE 50 mg レジメンは低用量よりも優れていましたが、50 mg から 200 mg tid では統計的に有意な差はありませんでした
単剤療法、またはスルホニル尿素薬、メトホルミン、またはインスリンとの併用療法による 2 型糖尿病患者の臨床経験
PRECOSE は、単独療法として、およびスルホニル尿素、メトホルミン、またはインスリン治療との併用療法として研究されました。 HbA1c レベルおよび食後 1 時間のグルコースレベルに対する治療効果は、米国で実施された 4 つのプラセボ対照二重盲検無作為試験について、それぞれ表 2 および 3 にまとめられています。以下に要約されているプラセボを差し引いた治療の違いは、これらすべての研究の両方の変数で統計的に有意でした。
研究 1 (n=109) には、食事療法のみのバックグラウンド治療を受けている患者が含まれていました。食事療法に PRECOSE を追加した平均効果は、HbA1c の変化が -0.78% であり、食後 1 時間の血糖値が -74.4 mg/dL 改善されました。
研究 2 (n=137) では、最大のスルホニル尿素療法に PRECOSE 25mg を追加した平均効果は、HbA1c の変化が -0.54% であり、食後 1 時間の血糖値が -33.5 mg/dL 改善されました。
試験 3 (n=147) では、最大メトホルミン療法に PRECOSE 50mg を追加した平均効果は、HbA1c の変化が -0.65% であり、食後 1 時間の血糖値が -34.3 mg/dL 改善されました。
研究 4 (n=145) では、インスリンによるバックグラウンド治療を受けている患者に PRECOSE を追加すると、HbA1c の平均変化が -0.69% になり、食後 1 時間の血糖値が -36.0 mg/dL 改善したことが示されました。
単剤療法として、またはスルホニル尿素、メトホルミン、またはインスリン治療と組み合わせた PRECOSE の 1 年間の研究がカナダで実施され、316 人の患者が一次有効性分析に含まれました (図 2)。ダイエット、スルホニル尿素群、メトホルミン群では、プリコース 50mg の追加によって生成された HbA1c の平均減少は 6 か月で統計的に有意であり、この効果は 1 年で持続しました。 PRECOSE でインスリン治療を受けている患者では、HbA1c が 6 か月で統計的に有意に減少し、1 年で減少の傾向が見られました。
図 2 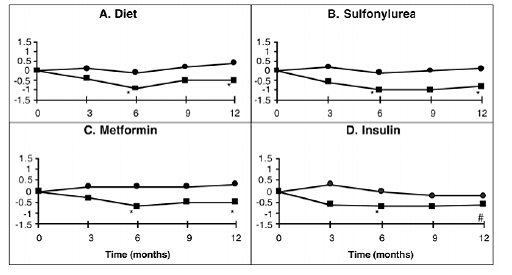
図 2: 2型糖尿病患者を対象に以下と組み合わせて使用した場合の、1年間のベースラインからのHbA1cレベルの平均変化に対するPRECOSE(III)およびプラセボ(III)の効果:(A)食事のみ。 (B) スルホニル尿素; (C) メトホルミン;または (D) インスリン。 6 ヶ月と 12 ヶ月での治療の違いがテストされました: * p
患者情報
患者は、各主食の開始時 (最初の一口) に PRECOSE 50mg を 1 日 3 回経口摂取するように指示されるべきです。患者が食事指導、定期的な運動プログラム、定期的な尿および/または血糖値の検査を継続して遵守することが重要です。
PRECOSE自体は絶食状態で投与しても低血糖を起こしません。しかし、スルホニル尿素薬とインスリンは血糖値を低下させ、症状を引き起こしたり、時には生命を脅かす低血糖を引き起こしたりする可能性があります. PRECOSE をスルホニル尿素またはインスリンと組み合わせて投与すると、血糖値がさらに低下するため、これらの薬剤の低血糖の可能性が高まる可能性があります。通常の使用状況下でメトホルミンのみを投与された患者では低血糖は発生せず、メトホルミン療法に PRECOSE を追加した患者で低血糖の発生率の増加は観察されませんでした。低血糖のリスク、その症状と治療、および低血糖を発症しやすくする状態について、患者と責任ある家族は十分に理解する必要があります。 PRECOSE 50mg はテーブル シュガーの分解を防ぐため、スルホニル尿素またはインスリンと組み合わせて PRECOSE を服用する場合、低血糖の症状を治療するために、患者はブドウ糖 (デキストロース、D-グルコース) をすぐに利用できるようにする必要があります。
PRECOSE で副作用が発生した場合、通常、治療の最初の数週間で発生します。最も一般的なのは、鼓腸、下痢、または腹部不快感などの軽度から中等度の胃腸への影響であり、一般に時間の経過とともに頻度と強度が減少します。

