Glucovance 400/2.50mg, 500/5mg Metformin 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
グルコバンス 2.50mg とは?
グルコバンス 400mg は、2 型糖尿病の症状を治療するために使用される処方薬です。グルコバンスは、単独で使用することも、他の薬と併用することもできます。
グルコバンスは、抗糖尿病薬、スルホニル尿素/ビグアニドと呼ばれる薬のクラスに属しています.
グルコバンス 2.50mg が子供に安全で効果的かどうかはわかっていません。
グルコバンス 400mg の副作用の可能性は何ですか?
グルコバンスは、次のような重大な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔、唇、舌、喉の腫れ、
- 腫れ、
- 急激な体重増加、
- 呼吸困難、
- 極端な弱さ、
- ぼやけた視界、
- 発汗、
- 話すのが苦手、
- 震え、
- 胃痛、
- 錯乱、
- 発作、
- 異常な筋肉痛、
- 呼吸困難、
- 胃痛、
- 嘔吐、
- 不規則な心拍数、
- めまい、
- 寒いです、
- 弱さ、そして
- 疲れ
上記の症状がある場合は、すぐに医療機関を受診してください。
グルコバンスの最も一般的な副作用は次のとおりです。
- 低血糖、
- 吐き気、
- 下痢、
- 胃のむかつき、そして
- 頭痛
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、Glucovance の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
GLUCOVANCE® (グリブリドおよびメトホルミン HCl) 錠剤には、2 型糖尿病の管理に使用される 2 つの経口血糖降下薬、グリブリドおよびメトホルミン塩酸塩が含まれています。
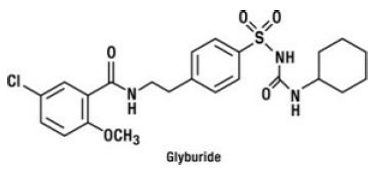
グリブリドは、スルホニル尿素系の経口血糖降下薬です。グリブリドの化学名は、1-[[p-[2-(5-クロロ-o-アニサミド)エチル]フェニル]スルホニル]-3-シクロヘキシル尿素です。グリブリドは、分子式が C23H28ClN3O5S で分子量が 494.01 の白色からオフホワイトの結晶性化合物です。グルコバンス5mgに使用されているグリブリドの粒度分布は、6μm以下のアンダーサイズ値が25%、7~10μm以下のアンダーサイズ値が50%、21μm以下のアンダーサイズ値が75%です。以下に構造式を示す。
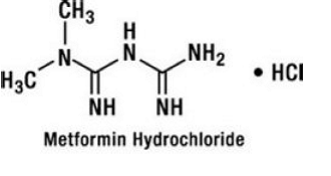
塩酸メトホルミンは、2 型糖尿病の管理に使用される経口血糖降下薬です。メトホルミン塩酸塩 (N,N-ジメチルイミドジカルボンイミディック ジアミド 一塩酸塩) は、スルホニル尿素、チアゾリジンジオン、または α-グルコシダーゼ阻害剤と化学的または薬理学的に関連していません。これは、分子式が C4H12ClN5 (一塩酸塩) で、分子量が 165.63 の白色からオフホワイトの結晶性化合物です。メトホルミン塩酸塩は、水に溶けやすく、アセトン、エーテル、クロロホルムにはほとんど溶けません。メトホルミンの pKa は 12.4 です。メトホルミン塩酸塩の 1% 水溶液の pH は 6.68 です。構造式は次のとおりです。
GLUCOVANCE 500mg は、グリブリド 1.25 mg と塩酸メトホルミン 250 mg、グリブリド 2.5 mg と塩酸メトホルミン 500 mg、グリブリド 5 mg と塩酸メトホルミン 500 mg を含む錠剤で経口投与できます。さらに、各錠剤には、微結晶性セルロース、ポビドン、クロスカルメロース ナトリウム、ステアリン酸マグネシウムなどの不活性成分が含まれています。錠剤はフィルムコーティングされており、色の違いがあります。
適応症
GLUCOVANCE (グリブリドおよびメトホルミン HCl) タブレットは、2 型糖尿病の成人の血糖コントロールを改善するための食事と運動の補助として示されています。
投薬と管理
一般的な考慮事項
GLUCOVANCE の投与量は、有効性と耐性の両方に基づいて個別化する必要がありますが、グリブリド 20 mg/メトホルミン 2000 mg の最大推奨 1 日投与量を超えないようにする必要があります。 低血糖(主にグリブリドによる)を回避し、消化管の副作用(主にメトホルミンによる)を軽減し、個々の患者の血糖を適切に制御するための最小有効用量。
初期治療時および用量調整中は、GLUCOVANCE 2.50mg に対する治療反応を判断し、患者の最小有効用量を特定するために、適切な血糖モニタリングを使用する必要があります。その後、約 3 か月ごとに HbA1c を測定し、治療の有効性を評価します。すべての 2 型糖尿病患者の治療目標は、FPG、PPG、および HbA1c を正常または可能な限り正常に近づけることです。理想的には、治療に対する反応は、FPG 単独よりも長期的な血糖コントロールのより良い指標である HbA (グリコシル化ヘモグロビン) を使用して評価する必要があります。
グリブリド(または他のスルホニル尿素)とメトホルミンを併用している患者を対象に、GLUCOVANCE 400mg 療法への切り替えの安全性と有効性を具体的に調べた研究は実施されていません。このような患者では血糖コントロールの変化が起こり、高血糖または低血糖の可能性があります。 2 型糖尿病の治療法を変更する場合は、注意して適切なモニタリングを行う必要があります。
食事と運動による血糖コントロールが不十分な患者におけるGLUCOVANCE
推奨開始用量: 1.25 mg/250 mg を 1 日 1 回または 2 回、食事と一緒に服用してください。
食事と運動だけでは高血糖が十分に管理できない 2 型糖尿病患者の場合、グルコヴァンス 400mg の推奨開始用量は、1 日 1 回 1.25mg/250mg の食事と一緒です。ベースラインの HbA1c > 9% または FPG > 200 mg/dL の患者の初期治療として、GLUCOVANCE 1.25 mg/250 mg の開始用量を 1 日 2 回、朝と夕食に使用することができます。用量は、2 週間ごとに 1 日 1.25 mg/250 mg ずつ増量し、血糖値を適切にコントロールするのに必要な最小有効量まで増量する必要があります。 GLUCOVANCE の初期治療としての臨床試験では、1 日あたりの総投与量が 10 mg/2000 mg を超えるという経験はありませんでした。 低血糖のリスクが高まるため、GLUCOVANCE 5 mg/500 mg を初期治療として使用しないでください。
グルコバンス 500mg スルホニル尿素および/またはメトホルミンによる血糖コントロールが不十分な患者における使用
推奨開始用量: 2.5 mg/500 mg または 5 mg/500 mg を 1 日 2 回、食事と一緒に服用してください。
グリブリド(または別のスルホニル尿素)またはメトホルミン単独で十分にコントロールされていない患者の場合、GLUCOVANCE の推奨開始用量は 2.5 mg/500 mg または 5 mg/500 mg を 1 日 2 回、朝と夕食と一緒に服用することです。低血糖を避けるために、グルコバンス 2.50mg の開始用量は、すでに摂取されているグリブリドまたはメトホルミンの 1 日用量を超えてはなりません。 1 日あたりの用量は、5 mg/500 mg を超えないように、血糖を適切にコントロールするための最小有効用量まで、または 1 日あたり最大用量 20 mg/2000 mg まで滴定する必要があります。
以前にグリブリド(または別のスルホニル尿素)とメトホルミンの併用療法を受けていた患者がグルコバンスに切り替えた場合、開始用量は、すでに服用しているグリブリド(または別のスルホニル尿素と同等の用量)とメトホルミンの 1 日量を超えてはなりません。患者は、このような切り替え後に低血糖の徴候と症状がないか注意深く監視する必要があり、グルコバンスの用量は、血糖を適切にコントロールするために上記のように調整する必要があります。
GLUCOVANCE療法へのチアゾリジンジオンの追加
GLUCOVANCE で十分にコントロールされていない患者には、チアゾリジンジオンを GLUCOVANCE 400mg 療法に追加することができます。グルコバンス療法にチアゾリジンジオンを追加すると、グルコバンス 500mg の現在の用量を継続し、チアゾリジンジオンをその推奨開始用量で開始することができます。追加の血糖コントロールが必要な患者の場合、チアゾリジンジオンの用量は、推奨される滴定スケジュールに基づいて増やすことができます。 GLUCOVANCE とチアゾリジンジオンで達成可能な血糖コントロールの向上は、1 日のどの時間帯でも低血糖の可能性を高める可能性があります。グルコバンス 5mg とチアゾリジンジオンの投与中に低血糖を発症した患者では、グルコバンスのグリブリド成分の用量を減らすことを考慮する必要があります。臨床的に保証されているように、糖尿病治療レジメンの他の成分の投与量の調整も考慮する必要があります。
コレセベラムを投与されている患者
コレセベラムをグリブリドと同時投与すると、最大血漿濃度とグリブリドへの総暴露量が減少します。したがって、GLUCOVANCE は、コレセベラムの少なくとも 4 時間前に投与する必要があります。
特定の患者集団
GLUCOVANCE は妊娠中の使用は推奨されていません。グルコバンスの初回および維持投与量は、高齢患者では腎機能が低下する可能性があるため、控えめにすべきです。投与量の調整には、腎機能の慎重な評価が必要です。一般に、高齢者、衰弱した患者、栄養失調の患者は、低血糖のリスクを避けるために、グルコバンスの最大用量まで漸増すべきではありません.特に高齢者では、メトホルミン関連乳酸アシドーシスの予防を助けるために、腎機能のモニタリングが必要です。 (見る 警告 .)
供給方法
グルコヴァンス®(グリブリド・メトホルミン塩酸塩)錠
グルコバンス 1.25mg/250mg 錠剤は、淡黄色のカプセル型で、面取りされた両凸のフィルムコーティング錠で、「 BMS 」 片面に型押しと「 6072 」 反対側にデボス加工。
グルコバンス 2.5mg/500mg 錠剤は、淡いオレンジ色のカプセル型で、面取りされた両凸のフィルムコーティング錠で、「 BMS 」 片面に型押しと「 6073 」 反対側にデボス加工。
グルコバンス 5mg/500mg 錠剤は、黄色のカプセル型で、面取りされた両凸のフィルムコーティング錠で、「 BMS 」 片面に型押しと「 6074 」 反対側にデボス加工。
保管所
25°C (77°F) までの温度で保管してください。 [見る USP制御の室温 .]
耐光性容器に分配する。
販売元: Bristol-Myers Squibb Company, Princeton, NJ 08543 USA 1158884A7. Rev 2013 年 10 月
副作用
グルコヴァンス
GLUCOVANCE 2.50mg を初期治療または二次治療として使用する二重盲検臨床試験では、合計 642 人の患者が GLUCOVANCE 2.50mg を受け取り、312 人がメトホルミン療法を受け、324 人がグリブリド療法を受け、161 人がプラセボを受けました。初期治療および二次治療としてグルコバンス(すべての強度)の臨床試験で報告された事象および有害事象の種類を報告した患者の割合を表6に示します。
GLUCOVANCEで治療された患者(n=365)におけるロシグリタゾンとプラセボの対照臨床試験では、181人の患者がロシグリタゾンとともにGLUCOVANCE 5mgを受け、184人がプラセボとともにGLUCOVANCEを受けました。
浮腫は、プラセボで治療された患者の 2.2% (4/184) と比較して、ロシグリタゾンで治療された患者の 7.7% (14/181) で報告されました。ロシグリタゾン治療を受けた患者では、平均 3 kg の体重増加が観察されました。
グリブリド錠で治療された患者で、ジスルフィラム様反応が報告されることはほとんどありません。
低血糖症
GLUCOVANCE 5mgの対照臨床試験では、医学的介入および/または薬物療法を必要とする低血糖エピソードはありませんでした。すべてのイベントは患者によって管理されました。グルコバンス 2.50mg の初期治療試験で報告された低血糖症状(めまい、震え、発汗、空腹など)の発生率を表 7 にまとめます。ベースライン HbA1c が 7% 未満の患者で最も高く、ベースライン HbA1c が 7% から 8% の患者で低く、ベースライン HbA1c が 8% を超える患者ではプラセボおよびメトホルミンと同等でした。ベースラインの HbA1c が 8% から 11% の患者で、初期治療としてグルコバンス 2.5 mg/500 mg を投与した場合、低血糖症状の頻度は 30% から 35% でした。スルホニル尿素単独で十分にコントロールされていない患者の二次治療として、グルコバンス 2.50mg で治療された全患者の約 6.8% が低血糖症状を経験しました。ロシグリタゾンを GLUCOVANCE 2.50mg 治療に追加した場合、プラセボ治療患者の 3.3% と比較して、患者の 22% が 1 回以上の指先測定値が 50 mg/dL 以下であると報告しました。すべての低血糖イベントは患者によって管理され、低血糖のために中止された患者は 1 人だけでした。 (見る 予防 : 全般的 : GLUCOVANCE療法へのチアゾリジンジオンの追加 .)
胃腸の反応
初期治療試験における胃腸(GI)副作用(下痢、吐き気/嘔吐、および腹痛)の発生率を表 7 にまとめます。GLUCOVANCE 500mg のすべての試験で、GI 症状は GLUCOVANCE 400mg で最も一般的な有害事象でした。より高い用量レベルでより頻繁に。
対照試験では、患者の 2% 未満が胃腸の有害事象のために GLUCOVANCE 500mg 治療を中止しました。
市販後の報告では、胆汁うっ滞性黄疸および肝炎がまれに発生し、肝不全に進行する可能性があります。この場合、グルコヴァンス 5mg の投与を中止してください。
薬物相互作用
グルコヴァンス
特定の薬は高血糖を引き起こす傾向があり、血糖コントロールの喪失につながる可能性があります.これらの薬物には、チアジドおよびその他の利尿薬、コルチコステロイド、フェノチアジン、甲状腺製品、エストロゲン、経口避妊薬、フェニトイン、ニコチン酸、交感神経刺激薬、カルシウムチャネル遮断薬、およびイソニアジドが含まれます。グルコバンス 400mg を服用している患者にこれらの薬剤を投与する場合は、患者の血糖コントロールが失われていないか注意深く観察する必要があります。グルコバンスを服用している患者からそのような薬剤を中止する場合は、患者の低血糖を注意深く観察する必要があります。メトホルミンは血漿タンパク質にほとんど結合していないため、血清タンパク質に広く結合しているスルホニル尿素と比較して、サリチレート、スルホンアミド、クロラムフェニコール、プロベネシドなどの高度にタンパク質結合した薬物と相互作用する可能性は低くなります。
グリブリド
スルホニル尿素の血糖降下作用は、非ステロイド性抗炎症剤やその他のタンパク質結合性の高い薬剤、サリチル酸、スルホンアミド、クロラムフェニコール、プロベネシド、クマリン、モノアミンオキシダーゼ阻害剤、ベータアドレナリン遮断薬などの特定の薬剤によって増強される可能性があります。グルコバンスを投与されている患者さんにこれらの薬剤を投与する場合は、患者さんの低血糖を注意深く観察する必要があります。 GLUCOVANCE 2.50mg を服用している患者からそのような薬剤を中止する場合、血糖コントロールの喪失について注意深く観察する必要があります。
ボセンタンと同時にグリブリドを投与された患者では、肝酵素上昇のリスク増加が観察されました。したがって、グルコバンスとボセンタンの併用は禁忌です。
グリブリドとフルオロキノロン系抗生物質であるシプロフロキサシンとの相互作用の可能性が報告されており、グリブリドの血糖降下作用が増強されます。この相互作用のメカニズムはわかっていません。
重度の低血糖につながる経口ミコナゾールと経口血糖降下薬との相互作用の可能性が報告されています。この相互作用が、ミコナゾールの静脈内、局所、または経膣製剤でも発生するかどうかは不明です。
コレセベラム: コレセベラムとグリブリドの併用投与により、グリブリドの AUC と Cmax がそれぞれ 32% と 47% 減少しました。グリブリド AUC および Cmax の減少は、1 時間前に投与した場合、それぞれ 20% および 15% であり、コレセベラムの 4 時間前に投与した場合、有意な変化はありませんでした (それぞれ -7% および 4%)。
メトホルミン塩酸塩
フロセミド
健康な被験者における単回投与のメトホルミン-フロセミド薬物相互作用研究では、両方の化合物の薬物動態パラメーターが同時投与によって影響を受けることが示されました。フロセミドは、メトホルミンの血漿および血中 Cmax を 22% 増加させ、血中 AUC を 15% 増加させましたが、メトホルミンの腎クリアランスに有意な変化はありませんでした。メトホルミンと併用した場合、フロセミドの Cmax と AUC は、単独で投与した場合よりもそれぞれ 31% と 12% 小さく、終末半減期は 32% 減少しましたが、フロセミドの腎クリアランスに大きな変化はありませんでした。慢性的に同時投与した場合のメトホルミンとフロセミドの相互作用に関する情報はありません。
ニフェジピン
正常な健康なボランティアを対象とした単回投与のメトホルミン-ニフェジピン薬物相互作用研究では、ニフェジピンの同時投与により、血漿メトホルミン Cmax および AUC がそれぞれ 20% および 9% 増加し、尿中への排泄量が増加することが示されました。 Tmax と半減期は影響を受けませんでした。ニフェジピンはメトホルミンの吸収を高めるようです。メトホルミンのニフェジピンへの影響は最小限でした。
カチオン性薬剤
尿細管分泌によって排除される陽イオン性薬物(例,アミロリド,ジゴキシン,モルヒネ,プロカインアミド,キニジン,キニーネ,ラニチジン,トリアムテレン,トリメトプリム,またはバンコマイシン)は,理論的には共通の尿細管輸送系をめぐって競合することによりメトホルミンと相互作用する可能性がある。メトホルミンと経口シメチジンとの間のこのような相互作用は、単回および複数回投与のメトホルミン-シメチジン薬物相互作用研究の両方で、正常な健康なボランティアで観察されており、ピークのメトホルミン血漿および全血濃度が 60% 増加し、血漿が 40% 増加しました。および全血メトホルミン AUC。単回投与試験では、排泄半減期に変化はありませんでした。メトホルミンは、シメチジンの薬物動態に影響を与えませんでした。このような相互作用は理論的なままですが (シメチジンを除く)、近位尿細管分泌系を介して排泄されるカチオン性薬剤を服用している患者には、注意深い患者モニタリングとグルコバンスおよび/または妨害薬の用量調整が推奨されます。
他の
健康なボランティアでは、メトホルミンとプロプラノロール、およびメトホルミンとイブプロフェンの薬物動態は、単回投与相互作用研究で同時投与された場合、影響を受けませんでした.
警告
メトホルミン塩酸塩
乳酸アシドーシス
乳酸アシドーシスは、グルコバンス錠(グリブリドおよびメトホルミン塩酸塩)による治療中にメトホルミンが蓄積することにより発生する、まれではあるが深刻な代謝合併症です。発生すると、約 50% の症例で致命的です。乳酸アシドーシスは、真性糖尿病を含む多くの病態生理学的状態に関連して発生することもあり、重大な組織低灌流および低酸素血症がある場合はいつでも発生する可能性があります。乳酸アシドーシスは、血中乳酸濃度の上昇 (> 5 mmol/L)、血液 pH の低下、陰イオンギャップの増加を伴う電解質障害、および乳酸/ピルビン酸比の上昇によって特徴付けられます。メトホルミンが乳酸アシドーシスの原因として関与している場合、メトホルミンの血漿中濃度は一般に 5 μg/mL を超えます。
メトホルミン塩酸塩を投与されている患者における乳酸アシドーシスの報告された発生率は非常に低いです (約 0.03 症例/1000 患者年、約 0.015 致死症例/1000 患者年)。臨床試験でメトホルミンにさらされた 20,000 人年以上の曝露では、乳酸アシドーシスの報告はありませんでした。報告された症例は主に、内因性腎疾患と腎低灌流の両方を含む重度の腎機能不全を伴う糖尿病患者で発生しており、多くの場合、複数の付随する医学的/外科的問題と複数の併用薬が設定されています。薬理学的管理を必要とするうっ血性心不全の患者、特に低灌流および低酸素血症のリスクがある不安定または急性うっ血性心不全の患者は、乳酸アシドーシスのリスクが高くなります。乳酸アシドーシスのリスクは、腎機能障害の程度と患者の年齢とともに増加します。したがって、乳酸アシドーシスのリスクは、メトホルミンを服用している患者の腎機能を定期的に監視し、メトホルミンの最小有効量を使用することによって大幅に減少する可能性があります.特に、高齢者の治療では、腎機能を注意深く監視する必要があります。グルコバンス 2.50mg の治療は、クレアチニンクリアランスの測定で腎機能が低下していないことが証明されない限り、80 歳以上の患者には開始しないでください。これらの患者は乳酸アシドーシスを発症しやすいからです。さらに、低酸素血症、脱水症、または敗血症に関連する状態が存在する場合は、GLUCOVANCE を速やかに中止する必要があります。肝機能が損なわれると、乳酸を除去する能力が大幅に制限される可能性があるため、GLUCOVANCE は一般に、肝疾患の臨床的または検査的証拠がある患者では避けるべきです。アルコールは乳酸代謝に対するメトホルミン塩酸塩の影響を増強するため、GLUCOVANCE 2.50mg を服用する場合、患者は急性または慢性の過剰なアルコール摂取に注意する必要があります。さらに、GLUCOVANCE 5mg は、血管内放射線造影検査の前および外科的処置の前に一時的に中止する必要があります (注意事項も参照)。
乳酸アシドーシスの発症はしばしば微妙であり、倦怠感、筋肉痛、呼吸困難、傾眠の増加、および非特異的な腹部不快感などの非特異的な症状のみを伴います.より顕著なアシドーシスを伴う低体温症、低血圧症、および抵抗性徐脈性不整脈が関連している可能性があります。患者および患者の主治医は、そのような症状の重要性を認識し、発生した場合は直ちに医師に通知するよう患者に指示する必要があります (注意事項も参照)。グルコヴァンス 500mg は、状況が明らかになるまで中止すること。血清電解質、ケトン、血糖値、および必要に応じて、血中 pH、乳酸値、さらには血中メトホルミン値も有用な場合があります。 GLUCOVANCE のいずれかの用量レベルで患者が安定すると、メトホルミンによる治療の開始時によくみられる胃腸症状は、薬物に関連する可能性は低くなります。胃腸症状のその後の発生は、乳酸アシドーシスまたは他の深刻な病気が原因である可能性があります.
GLUCOVANCE を服用している患者の空腹時静脈血漿乳酸値が正常上限を超えているが 5 mmol/L 未満であっても、必ずしも乳酸アシドーシスが差し迫っていることを示すわけではなく、コントロール不良の糖尿病や肥満、激しい身体活動など、他の機序によって説明できる可能性があります。または十分な取り扱いにおける技術的な問題。 (注意事項も参照してください。)
乳酸アシドーシスは、ケトアシドーシス (ケトン尿症およびケトン血症) の証拠を欠く代謝性アシドーシスを有する糖尿病患者で疑われるべきです。
乳酸アシドーシスは、病院で治療しなければならない緊急事態です。グルコバンス 500mg を服用している乳酸アシドーシスの患者では、直ちに薬剤を中止し、一般的な支持療法を速やかに開始する必要があります。メトホルミン塩酸塩は透析可能であるため (良好な血行動態条件下で最大 170 mL/min のクリアランス)、アシドーシスを是正し、蓄積したメトホルミンを除去するために、迅速な血液透析が推奨されます。このような管理により、多くの場合、症状の迅速な逆転と回復がもたらされます。 (禁忌および使用上の注意も参照してください。)
心血管死亡リスクの増加に関する特別な警告
経口血糖降下薬の投与は、食事のみまたは食事とインスリンによる治療と比較して、心血管死亡率の増加と関連していることが報告されています。この警告は、University Group Diabetes Program (UGDP) によって実施された研究に基づいています。これは、インスリン非依存性糖尿病患者の血管合併症の予防または遅延における血糖降下薬の有効性を評価するために設計された長期前向き臨床試験です。この研究には、4 つの治療グループのうちの 1 つに無作為に割り当てられた 823 人の患者が含まれていました (Diabetes 19 (Suppl. 2):747-830, 1970)。
UGDP は、食事療法と固定用量のトルブタミド (1 日 1.5g) で 5 ~ 8 年間治療された患者は、食事療法のみで治療された患者の約 2.5 倍の心血管死亡率を示したと報告しました。総死亡率の有意な増加は観察されませんでしたが、心血管死亡率の増加に基づいてトルブタミドの使用が中止されたため、研究が全体的な死亡率の増加を示す機会が制限されました.これらの結果の解釈に関する論争にもかかわらず、UGDP 研究の調査結果は、この警告の適切な根拠を提供します。患者には、グリブリドの潜在的なリスクと利点、および代替療法について説明する必要があります。
この研究にはスルホニル尿素クラスの 1 つの薬物 (トルブタミド) のみが含まれていましたが、安全性の観点から、この警告はこのクラスの他の血糖降下薬にも適用される可能性があると考えるのが賢明です。そして化学構造。
予防
全般的
大血管転帰
GLUCOVANCE 5mgまたはその他の抗糖尿病薬による大血管リスクの減少の決定的な証拠を確立する臨床研究はありません.
グルコヴァンス
低血糖症
GLUCOVANCE 400mg は低血糖または低血糖症状を引き起こす可能性があるため、潜在的な低血糖エピソードを回避するには、適切な患者の選択、投薬、および指示が重要です。カロリー摂取量が不足している場合、激しい運動がカロリー補給によって補われていない場合、または他の血糖降下剤またはエタノールと併用している場合、低血糖のリスクが高まります。腎不全または肝不全は、グリブリドとメトホルミン塩酸塩の両方の薬物レベルの上昇を引き起こす可能性があり、肝不全は糖新生能力も低下させる可能性があり、どちらも低血糖反応のリスクを高めます.高齢者、衰弱した患者、または栄養失調の患者、および副腎または下垂体の機能不全またはアルコール中毒の患者は、特に血糖降下作用を受けやすい.低血糖は、高齢者やベータアドレナリン遮断薬を服用している人では認識しにくい場合があります.
グリブリド
溶血性貧血
グルコース-6-リン酸デヒドロゲナーゼ (G6PD) 欠乏症の患者をスルホニル尿素薬で治療すると、溶血性貧血を引き起こす可能性があります。 GLUCOVANCE 400mg はスルホニル尿素薬のクラスに属しているため、G6PD 欠乏症の患者には注意が必要であり、非スルホニル尿素の代替薬を検討する必要があります。市販後の報告では、溶血性貧血は G6PD 欠損症を知らなかった患者でも報告されています。
メトホルミン塩酸塩
腎機能のモニタリング
メトホルミンは腎臓から実質的に排泄されることが知られており、メトホルミンの蓄積と乳酸アシドーシスのリスクは、腎機能の障害の程度とともに増加します。したがって、血清クレアチニン値が年齢の正常上限を超えている患者には、GLUCOVANCE を投与しないでください。加齢は腎機能の低下と関連しているため、高齢の患者では、GLUCOVANCE 400mgを慎重に滴定して、十分な血糖効果を得るための最小用量を確立する必要があります.高齢患者、特に 80 歳以上の患者では、腎機能を定期的に監視する必要があり、通常、GLUCOVANCE 2.50mg は最大用量まで増量すべきではありません ( 警告 と 投薬と管理 )。 GLUCOVANCE 2.50mg 治療の開始前、およびその後は少なくとも年 1 回、腎機能を評価し、正常であることを確認する必要があります。腎機能障害の発症が予想される患者では、腎機能をより頻繁に評価し、腎機能障害の証拠が存在する場合はグルコバンスを中止する必要があります。
腎機能またはメトホルミンの性質に影響を与える可能性のある併用薬の使用
腎機能に影響を与える可能性があるか、重大な血行動態の変化をもたらす可能性がある、または腎尿細管分泌によって排出されるカチオン性薬剤など、メトホルミンの処理を妨げる可能性がある併用薬( 薬物相互作用 )、注意して使用する必要があります。
血管内ヨード造影剤の使用を伴う放射線検査(例えば、静脈内尿路造影、静脈内胆管造影、血管造影、および血管内造影剤を使用したコンピュータ断層撮影(CT)スキャン)
ヨウ素化物質を用いた血管内造影検査は、腎機能の急激な変化につながる可能性があり、メトホルミンを投与されている患者の乳酸アシドーシスと関連付けられています ( 禁忌 )。したがって、そのような研究が予定されている患者では、GLUCOVANCE 400mg は、処置時または処置前に一時的に中止し、処置後 48 時間は投与を控え、腎機能が再評価され、腎機能が低下していることが判明した後にのみ再開する必要があります。正常。
低酸素状態
あらゆる原因による心血管虚脱(ショック)、急性うっ血性心不全、急性心筋梗塞、および低酸素血症を特徴とするその他の状態は、乳酸アシドーシスと関連しており、腎前性高窒素血症を引き起こす可能性もあります。グルコバンス 2.50mg を服用している患者さんにこのような事象が発生した場合は、速やかに服用を中止してください。
外科処置
GLUCOVANCE 400mg 療法は、外科的処置のために一時的に中断する必要があり (食物や水分の摂取制限に関連しない軽微な処置を除く)、患者の経口摂取が再開され、腎機能が正常であると評価されるまで再開しないでください。
アルコール摂取量
アルコールは、乳酸代謝に対するメトホルミンの効果を増強することが知られています。したがって、GLUCOVANCE の投与中は、急性または慢性の過度のアルコール摂取に注意する必要があります。アルコールは肝臓の糖新生能力に影響を与えるため、低血糖のリスクも高める可能性があります。
肝機能障害
肝機能の障害は乳酸アシドーシスの一部の症例と関連しているため、GLUCOVANCE 500mg は一般に、肝疾患の臨床的または検査的証拠がある患者では避けるべきです。
ビタミン B12 レベル
メトホルミンを 29 週間投与した対照臨床試験では、患者の約 7% で、臨床症状を伴わずに、以前は正常だった血清ビタミン B12 が正常値以下のレベルにまで低下したことが観察されました。しかし、おそらくB12-内因性因子複合体からのB12吸収の干渉によるこのような減少は、貧血と関連することは非常にまれであり、メトホルミンまたはビタミンB補給の中止により急速に元に戻るようです.メトホルミンを服用している患者には、毎年の血液学的パラメーターの測定が推奨され、明らかな異常は適切に調査および管理する必要があります。 予防 : 臨床検査 )。
特定の人(ビタミンB12またはカルシウムの摂取または吸収が不十分な人)は、ビタミンB12レベルが正常以下になる傾向があるようです.これらの患者では、2 ~ 3 年間隔で定期的に血清ビタミン B12 を測定することが有用な場合があります。
以前にコントロールされた 2 型糖尿病患者の臨床状態の変化
以前にメトホルミンで十分にコントロールされていた 2 型糖尿病の患者が、臨床検査値の異常または臨床的疾患(特に漠然とした明確な疾患)を発症した場合は、ケトアシドーシスまたは乳酸アシドーシスの証拠について迅速に評価する必要があります。評価には、血清電解質とケトン、血糖、および必要に応じて血液の pH、乳酸、ピルビン酸、およびメトホルミンのレベルを含める必要があります。いずれかの形態のアシドーシスが発生した場合、GLUCOVANCE を直ちに中止し、他の適切な是正措置を開始する必要があります (以下も参照)。 警告 )。
GLUCOVANCE 500mg療法へのチアゾリジンジオンの追加
低血糖症
GLUCOVANCE 2.50mg をチアゾリジンジオンと組み合わせて投与されている患者は、低血糖のリスクがある可能性があります。
体重の増加
グルコヴァンス 5mg にロシグリタゾンを追加すると、チアゾリジンジオン療法単独で報告された体重増加と同様の体重増加が見られました。
肝臓への影響
チアゾリジンジオンを GLUCOVANCE 2.50mg と組み合わせて使用する場合は、チアゾリジンジオンに関するラベルの推奨事項に従って、肝機能検査の定期的なモニタリングを実施する必要があります。
患者様向け情報
グルコヴァンス
GLUCOVANCE 500mg と代替療法の潜在的なリスクと利点を患者に知らせる必要があります。彼らはまた、食事の指示を守ることの重要性についても知らされるべきです。定期的な運動プログラム;血糖、グリコシル化ヘモグロビン、腎機能、および血液学的パラメータの定期的な検査。
メトホルミン療法に関連する乳酸アシドーシスのリスク、その症状、およびその発症の素因となる状態については、警告および注意事項のセクションに記載されているように、患者に説明する必要があります。原因不明の過呼吸、筋肉痛、倦怠感、異常な傾眠、またはその他の非特異的な症状が発生した場合は、グルコバンスを直ちに中止し、医師に速やかに通知するよう患者に助言する必要があります。 GLUCOVANCE のいずれかの用量レベルで患者が安定すれば、メトホルミン療法の開始時によくみられる胃腸症状は、薬物に関連する可能性は低くなります。胃腸症状のその後の発生は、乳酸アシドーシスまたは他の深刻な病気が原因である可能性があります.
低血糖のリスク、その症状と治療、および低血糖を発症しやすい状態について、患者と責任ある家族に説明する必要があります。
GLUCOVANCE の投与中は、急性または慢性の過度のアルコール摂取に注意する必要があります。 (見る 患者情報の印刷 下。)
臨床検査
定期的な空腹時血糖 (FBG) および HbA1c 測定を実施して、治療効果をモニターする必要があります。
血液学的パラメータ(ヘモグロビン/ヘマトクリットおよび赤血球指数など)および腎機能(血清クレアチニン)の初期および定期的なモニタリングを、少なくとも年に1回は実施する必要があります。メトホルミン療法で巨赤芽球性貧血が見られることはめったにありませんが、これが疑われる場合は、ビタミン B12 欠乏症を除外する必要があります。
発がん、突然変異誘発、生殖能力の障害
GLUCOVANCE に配合された製品を使用した動物実験は実施されていません。以下のデータは、個々の製品で実施された調査結果に基づいています。
グリブリド
グリブリドをラットに最大 300 mg/kg/日 (体表面積の比較に基づくグルコバンス 5 mg のグリブリド成分の 1 日最大推奨用量 [MRHD] の最大推奨用量 20 mg の約 145 倍) を 18 か月間投与した研究で明らかになった。発がん性の影響はありません。マウスにおけるグリブリドの2年間の発癌性研究では、治療に関連した腫瘍の証拠はありませんでした.
次の in vitro 試験では、グリブリド単独の変異原性の証拠はありませんでした: サルモネラ ミクロソーム試験 (エイムズ試験) および DNA 損傷/アルカリ溶出試験。
メトホルミン塩酸塩
ラット (投与期間 104 週間) およびマウス (投与期間 91 週間) において、それぞれ 900 mg/kg/日および 1500 mg/kg/日までの用量で、メトホルミン単独で長期発がん性試験が実施されました。これらの用量は、体表面積の比較に基づいて、グルコヴァンス 400mg のメトホルミン成分 2000mg の MRHD 用量の約 4 倍です。雌雄いずれのマウスにおいても、メトホルミン単独での発がん性の証拠は見つかりませんでした。同様に、雄ラットでは、メトホルミン単独で腫瘍形成能は観察されませんでした。しかし、900 mg/kg/日のメトホルミン単独で治療した雌ラットでは、良性の間質性子宮ポリープの発生率が増加しました。
次の in vitro 試験では、メトホルミン単独の変異原性の証拠はありませんでした: Ames 試験 (S. typhimurium)、遺伝子変異試験 (マウスリンパ腫細胞)、または染色体異常試験 (ヒトリンパ球)。 in vivo マウス小核試験の結果も陰性でした。
オスまたはメスのラットの受胎能は、体表面積の比較に基づくグルコバンス 400mg のメトホルミン成分の MRHD 用量の約 3 倍である 600mg/kg/日という高用量で投与された場合、メトホルミン単独では影響を受けませんでした。
妊娠
催奇形性効果
妊娠カテゴリーB
最近の情報は、妊娠中の異常な血糖値が先天性異常の発生率が高いことと関連していることを強く示唆しています.ほとんどの専門家は、妊娠中に血糖値をできるだけ正常に近づけるためにインスリンを使用することを推奨しています。動物の繁殖研究は常に人間の反応を予測できるわけではないため、明確に必要でない限り、妊娠中はグルコヴァンス 400mg を使用しないでください。 (下記参照。)

グルコバンスまたはその個々の成分を使用した妊娠中の女性を対象とした、十分に管理された研究はありません。 GLUCOVANCE に配合された製品を使用した動物実験は実施されていません。以下のデータは、個々の製品で実施された調査結果に基づいています。
グリブリド
体表面積の比較に基づいて、グルコヴァンス 500mg のグリブリド成分 20mg の MRHD 用量の 500 倍までの用量で、ラットとウサギで生殖研究が実施され、グリブリドによる生殖能力の障害または胎児への害の証拠は明らかにされませんでした。
メトホルミン塩酸塩
メトホルミン単独では、600 mg/kg/日までの用量でラットまたはウサギに催奇形性はありませんでした。これは、ラットとウサギの体表面積の比較に基づいて、グルコバンス 500mg のメトホルミン成分 2000mg の MRHD 用量の約 2 倍と 6 倍の暴露量を表しています。胎児濃度の決定は、メトホルミンに対する部分的な胎盤バリアを示しました。
非催奇形効果
分娩時にスルホニル尿素薬を投与されていた母親から生まれた新生児で、長期にわたる重度の低血糖(4~10日)が報告されています。これは、半減期が長い薬剤を使用することでより頻繁に報告されています。妊娠中のグルコヴァンス 400mg の使用は推奨されません。ただし、使用する場合は、出産予定日の2週間前までにグルコヴァンスを中止してください。 (見る 妊娠 : 催奇形性効果 : 妊娠カテゴリーB .)
授乳中の母親
グリブリドが母乳中に排泄されるかどうかは不明ですが、一部のスルホニル尿素薬は母乳中に排泄されることが知られています。授乳中のラットでの研究では、メトホルミンが乳汁中に排泄され、血漿中のレベルに匹敵するレベルに達することが示されています。同様の研究は、授乳中の母親では実施されていません。授乳中の乳児に低血糖が発生する可能性があるため、母親にとっての薬剤の重要性を考慮して、授乳を中止するかグルコバンスを中止するかを決定する必要があります。 GLUCOVANCE を中止し、食事だけでは血糖コントロールが不十分な場合は、インスリン療法を検討する必要があります。
小児用
GLUCOVANCE 500mg の安全性と有効性は、2 型糖尿病の合計 167 人の小児患者 (9 歳から 16 歳の範囲) を対象とした実薬対照二重盲検 26 週間無作為化試験で評価されました。 GLUCOVANCE 500mg は、ベースラインからの HbA1c の低下に関して、統計的にメトホルミンまたはグリブリドのいずれよりも優れていることが示されませんでした (表 5 を参照)。この試験では、GLUCOVANCE 2.50mg に関連する予想外の安全性に関する知見はありませんでした。
高齢者の使用
二重盲検臨床試験でGLUCOVANCEを投与された642人の患者のうち、23.8%が65歳以上、2.8%が75歳以上でした。非盲検臨床試験でグルコバンス 500mg を投与された 1,302 人の患者のうち、20.7% が 65 歳以上、2.5% が 75 歳以上でした。これらの患者と若い患者の間で有効性または安全性に全体的な違いは観察されず、他の報告された臨床経験では、高齢者と若い患者の間の反応の違いは特定されていませんが、一部の高齢者の感度が高いことは除外できません.
メトホルミン塩酸塩は腎臓から実質的に排泄されることが知られており、腎機能が低下している患者では重篤な副作用のリスクが高くなるため、グルコヴァンス 500mg は腎機能が正常な患者にのみ使用する必要があります。 禁忌 、 警告 、 と 臨床薬理学 : 薬物動態 )。加齢は腎機能の低下と関連しているため、グルコバンス 5mg は加齢に伴い慎重に使用する必要があります。用量の選択には注意が必要であり、腎機能の注意深い定期的なモニタリングに基づく必要があります。一般に、高齢患者はグルコバンスの最大用量まで漸増すべきではありません(以下も参照)。 警告 と 投薬と管理 )。
過剰摂取
グリブリド
グリブリド錠を含むスルホニル尿素の過剰摂取は、低血糖を引き起こす可能性があります。軽度の低血糖症状で、意識消失や神経学的所見がない場合は、ブドウ糖の経口摂取と、薬剤の投与量および/または食事パターンの調整で積極的に治療する必要があります。医師が患者が危険にさらされていないことを確認するまで、綿密な監視を続ける必要があります。昏睡、発作、またはその他の神経学的障害を伴う重度の低血糖反応はまれに発生しますが、緊急入院を必要とする医学的緊急事態を構成します。低血糖性昏睡と診断された場合、または疑われる場合は、患者に濃縮 (50%) ブドウ糖溶液を急速に静脈内注射する必要があります。これに続いて、血糖値を 100 mg/dL を超えるレベルに維持する速度で、より希薄な (10%) グルコース溶液を持続的に注入する必要があります。明らかな臨床的回復後に低血糖が再発する可能性があるため、最低 24 ~ 48 時間は患者を綿密に監視する必要があります。
メトホルミン塩酸塩
50gを超える量の摂取を含む、メトホルミン塩酸塩の過剰摂取が発生しています。約10%の症例で低血糖が報告されていますが、メトホルミン塩酸塩との因果関係は確立されていません。乳酸アシドーシスは、メトホルミン過剰摂取症例の約 32% で報告されています。 警告 )。メトホルミンは、良好な血行動態条件下で最大 170 mL/min のクリアランスで透析可能です。したがって、血液透析は、メトホルミンの過剰摂取が疑われる患者からの蓄積薬物の除去に役立つ可能性があります。
禁忌
GLUCOVANCE 2.50mg は、以下の患者には禁忌です。
グルコバンス 500mg は、ヨード造影剤の血管内投与を含む放射線検査を受けている患者では、一時的に中止する必要があります。このような製品を使用すると、腎機能が急激に変化する可能性があるためです。 (こちらもご覧ください 予防 .)
臨床薬理学
作用機序
GLUCOVANCE は、2 型糖尿病患者の血糖コントロールを改善するために、グリブリドとメトホルミン塩酸塩という 2 つの血糖降下薬を組み合わせて作用機序を補完します。
グリブリドは、膵臓からのインスリンの放出を刺激することにより、血糖を急激に低下させるように思われます。この効果は、膵島のベータ細胞の機能に依存します。グリブリドが長期投与中に血糖を低下させるメカニズムは明確に確立されていません。 2 型糖尿病患者に長期投与すると、薬物に対するインスリン分泌反応が徐々に低下するにもかかわらず、血糖降下効果は持続します。膵外作用は、経口スルホニル尿素系血糖降下薬の作用機序に関与している可能性があります。
メトホルミン塩酸塩は、2 型糖尿病患者の耐糖能を改善し、基礎および食後の両方の血漿グルコースを低下させる抗高血糖剤です。メトホルミン塩酸塩は、肝臓のグルコース産生を減少させ、グルコースの腸吸収を減少させ、末梢グルコースの取り込みと利用を増加させることによりインスリン感受性を改善します.
薬物動態
吸収とバイオアベイラビリティ
グルコヴァンス
GLUCOVANCE 2.5 mg/500 mg および 5 mg/500 mg のバイオアベイラビリティ研究では、グリブリド成分の血漿中濃度対時間曲線下の平均面積 (AUC) は、Micronase® よりもそれぞれ 18% および 7% 大きかったメトホルミンと併用するグリブリドのブランド。したがって、GLUCOVANCE のグリブリド成分は Micronase® と生物学的に同等ではありません。 GLUCOVANCE 400mg のメトホルミン成分は、グリブリドと同時投与されたメトホルミンと生物学的に同等です。
GLUCOVANCE 5 mg/500 mg 錠を 20% ブドウ糖溶液または 20% ブドウ糖溶液と一緒に食事とともに 1 回投与した後、Cmax に対する食事の影響はなく、グリブリドの AUC に対する食事の影響は比較的わずかでした。成分。グリブリド成分の Tmax は、20% グルコース溶液で空腹時に投与された同じ錠剤強度と比較して、食事で 7.5 時間から 2.75 時間に短縮されました。食後のグリブリドの早期 Tmax の臨床的意義は知られていない。メトホルミン成分の薬物動態に対する食物の影響は不確定でした。
グリブリド
Micronase® 錠剤を正常な被験者に単回投与した研究では、1 時間以内にグリブリドが有意に吸収され、約 4 時間で薬物レベルがピークに達し、24 時間で低いが検出可能なレベルになることが示されました。グリブリドの平均血清レベルは、血清濃度-時間曲線の下の領域によって反映されるように、対応する用量の増加に比例して増加します。グルコバンス 500mg と単一成分のグリブリド製品との間の生物学的同等性は確立されていません。
メトホルミン塩酸塩
絶食条件下で投与される 500 mg メトホルミン塩酸塩錠剤の絶対バイオアベイラビリティは、約 50% から 60% です。 500 mg と 1500 mg、および 850 mg から 2550 mg のメトホルミン錠剤の単回経口投与を使用した研究では、用量の増加に伴う用量比例性の欠如が示されています。これは、排泄の変化ではなく、吸収の減少によるものです。食物は、メトホルミンの吸収の程度を減少させ、吸収をわずかに遅らせます。これは、850 mg を 1 回投与した後、血漿中のピーク濃度が約 40% 低下し、AUC が 25% 低下し、血漿濃度がピークに達するまでの時間が 35 分間延長されることによって示されます。空腹時に投与された同じ錠剤強度と比較して、食物と一緒にメトホルミンの錠剤。これらの減少の臨床的関連性は不明です。
分布
グリブリド
スルホニル尿素薬は、血清タンパク質に広範囲に結合します。他の薬物によるタンパク質結合部位からの置換は、血糖降下作用の増強につながる可能性があります。 In vitro では、グリブリドが示すタンパク質結合は主に非イオン性ですが、他のスルホニル尿素 (クロルプロパミド、トルブタミド、トラザミド) は主にイオン性です。フェニルブタゾン、ワルファリン、サリチル酸塩などの酸性薬物は、非イオン結合グリブリドよりもはるかに大きな範囲で血清タンパク質からイオン結合スルホニル尿素を置換します。このタンパク質結合の違いにより、臨床使用においてグリブリド錠剤との薬物相互作用が減少することは示されていません。
メトホルミン塩酸塩
850 mg の単回経口投与後のメトホルミンの見かけの分布容積 (V/F) は、平均 654±358 L でした。メトホルミンは血漿タンパク質にほとんど結合していません。メトホルミンは、おそらく時間の関数として赤血球に分配されます。メトホルミンの通常の臨床用量および投与スケジュールでは、メトホルミンの定常状態血漿濃度は 24 ~ 48 時間以内に達し、一般に
代謝と排泄
グリブリド
正常な健康な人の血清中のグリブリドの減少は二相性です。終末半減期は約 10 時間です。グリブリドの主な代謝産物は、4-トランス-ヒドロキシ誘導体です。 2 番目の代謝産物である 3-cis-ヒドロキシ誘導体も発生します。これらの代謝産物は、ウサギでは弱い活性しか持たないため(それぞれ、グリブリドの 1/400 および 1/40 の活性)、おそらくヒトでは有意な血糖降下作用に寄与しないと考えられます。グリブリドは胆汁および尿中に代謝物として排泄され、各経路で約 50% が排泄されます。この二重排泄経路は、主に尿中に排泄される他のスルホニル尿素とは質的に異なります。
メトホルミン塩酸塩
健常者を対象とした静脈内単回投与試験では、メトホルミンは変化せずに尿中に排泄され、肝臓での代謝(ヒトでは代謝物は確認されていません)も胆汁排泄も受けないことが示されています。腎クリアランス (表 1 を参照) はクレアチニン クリアランスの約 3.5 倍であり、尿細管分泌がメトホルミン排泄の主要な経路であることを示しています。経口投与後、吸収された薬物の約 90% が最初の 24 時間以内に腎経路を介して排出され、血漿排出半減期は約 6.2 時間です。血液中の排出半減期は約 17.6 時間であり、赤血球塊が分布のコンパートメントである可能性があることを示唆しています。
特別な集団
2型糖尿病患者
型糖尿病患者におけるグリブリドの複数回投与研究では、単回投与研究と同様の薬物レベルの濃度-時間曲線が示され、組織デポーに薬物が蓄積しないことが示されています。
正常な腎機能の存在下では、2 型糖尿病患者と健常者の間でメトホルミンの単回投与または複数回投与の薬物動態に違いはなく (表 1 を参照)、通常の臨床検査ではどちらのグループにもメトホルミンの蓄積はありません。用量。
肝不全
グリブリドまたはメトホルミンのいずれについても、肝不全患者における薬物動態研究は実施されていません。
腎不全
腎不全患者におけるグリブリドの薬物動態に関する情報はありません。
腎機能が低下した患者(クレアチニンクリアランスに基づく)では、メトホルミンの血漿および血中半減期が延長され、クレアチニンクリアランスの減少に比例して腎クリアランスが減少します(表1を参照。 警告 )。
老年医学
高齢患者におけるグリブリドの薬物動態に関する情報はありません。
健康な高齢者を対象としたメトホルミンの制御された薬物動態研究からの限られたデータは、健康な若い対象者と比較した場合、総血漿クリアランスが減少し、半減期が延長され、Cmax が増加することを示唆しています。これらのデータから、加齢に伴うメトホルミンの薬物動態の変化は、主に腎機能の変化によって説明されるようです (表 1 を参照)。クレアチニンクリアランスの測定で腎機能が低下していないことが示されない限り、80歳以上の患者にはメトホルミン治療を開始しないでください。
小児科
GLUCOPHAGE® (メトホルミン塩酸塩) 500 mg 錠剤を食事とともに 1 回経口投与した後、幾何平均メトホルミン Cmax および AUC は、小児 2 型糖尿病患者 (12 ~ 16 歳) と性別および体重が一致した健康な患者の間で 5% 未満の差がありました。成人 (20 ~ 45 歳)、すべて正常な腎機能を備えています。
GLUCOVANCE 錠を 1 回経口投与した後、2 型糖尿病の小児患者 (11 ~ 16 歳、n=28、平均体重 97 kg) におけるグリブリド C の用量正規化幾何平均と AUC の差は 6% 未満でした。健康な成人の歴史的価値から。
性別
グリブリドの薬物動態に対する性別の影響に関する情報はありません。
メトホルミンの薬物動態パラメーターは、性別 (男性 = 19、女性 = 16) に従って分析した場合、2 型糖尿病の有無にかかわらず被験者で有意な差はありませんでした。同様に、2 型糖尿病患者を対象とした対照臨床試験では、メトホルミンの抗高血糖効果は男性と女性で同等でした。
人種
グリブリドの薬物動態における人種差に関する情報はありません。
人種によるメトホルミンの薬物動態パラメーターの研究は行われていません。 2 型糖尿病患者を対象としたメトホルミンの対照臨床研究では、血糖降下作用は白人 (n=249)、黒人 (n=51)、ヒスパニック系 (n=24) で同等でした。
臨床研究
食事と運動だけでは血糖コントロールが不十分な患者
米国の 20 週間の二重盲検多施設臨床試験では、高血糖が食事と運動のみでは適切にコントロールされなかった (ベースラインの空腹時血漿グルコース [FPG]
GLUCOVANCE による治療は、グリブリド、メトホルミン、またはプラセボと比較して、HbA および食後血漿グルコース (PPG) の大幅な減少をもたらしました。また、GLUCOVANCE療法は、グリブリド、メトホルミン、またはプラセボと比較してFPGの大幅な減少をもたらしましたが、グリブリドおよびメトホルミンとの差は統計的有意性に達しませんでした.
GLUCOVANCE 2.50mg 治療に関連する脂質プロファイルの変化は、グリブリド、メトホルミン、およびプラセボで見られたものと同様でした。
上記の二重盲検プラセボ対照試験では、HbA1c
スルホニル尿素単独で血糖コントロールが不十分な患者
米国での 16 週間の二重盲検実薬対照臨床試験では、少なくともスルホニル尿素(例、グリブリド 10 mg、グリピジド 20 mg)の最大用量の半分を無作為に割り付け、グリブリド(固定用量、20 mg)、メトホルミン(500 mg)、グルコバンス 2.5 mg/500 mg、またはグルコバンス 5 mg を投与/500mg。メトホルミンと GLUCOVANCE の用量は、FPG
16 週間後、グリブリドまたはメトホルミン療法に無作為に割り付けられた患者の平均 HbA に有意な変化はありませんでした。 GLUCOVANCE 2.50mg を 1 日あたり最大 20 mg/2000 mg の用量で投与すると、グリブリドまたはメトホルミン単独と比較して、HbA 、FPG、および PPG がベースラインから大幅に低下しました。
GLUCOVANCE 400mg療法へのチアゾリジンジオンの追加
米国の 24 週間の二重盲検多施設臨床試験では、現在の経口血糖降下薬(単剤療法または併用療法)で十分にコントロールされていない 2 型糖尿病患者が、最初に非盲検グルコバンス 2.5 mg/500 mg 錠に切り替えられ、滴定されました。 1 日最大 10 mg/2000 mg まで。合計 365 名の患者 (HbA1c > 7.0% および ≤ 10%) が 10 ~ 12 週間の毎日のグルコバンス 500mg 投与量で少なくとも 7.5 mg/1500 mg の投与を受けた後、不十分にコントロールされた (HbA1c > 7.0% および ≤ 10%) 患者は無作為に割り付けられ、ロシグリタゾン 4 mg またはプラセボによるアドオン療法を 1 日 1 回投与されました。 . 8 週間後、ロシグリタゾンの用量は、126 mg/dL または HbA1c
GLUCOVANCE 400mgで十分な血糖コントロールを達成できなかった患者では、ロシグリタゾンを追加すると、プラセボと比較してHbAとFPGが大幅に低下しました。
患者情報
グルコヴァンス® (グリブリドおよびメトホルミン塩酸塩) 錠剤
警告: メトホルミン塩酸塩を服用した少数の人々は、乳酸アシドーシスと呼ばれる深刻な状態を発症しました.乳酸アシドーシスを防ぐには、腎臓が正常に機能している必要があります。腎臓に問題のあるほとんどの人はグルコヴァンスを服用すべきではありません。 (質問No.9~13参照)
Q1.なぜグルコヴァンス5mgを服用する必要があるのですか?
あなたの医師は、あなたの 2 型糖尿病を治療するためにグルコヴァンス 500mg を処方しました。これは、インスリン非依存性糖尿病としても知られています。
Q2. 2型糖尿病とは?
糖尿病の人は、十分なインスリンを作ることができず、体が作るインスリンに正常に反応することができません.これが起こると、血液中に糖(ブドウ糖)が蓄積します。これは、腎臓の損傷、切断、失明などの深刻な医学的問題につながる可能性があります。糖尿病は心臓病とも密接に関係しています。糖尿病治療の主な目標は、血糖値を正常なレベルに下げることです。
Q3.なぜ 2 型糖尿病をコントロールすることが重要なのですか?
糖尿病治療の主な目標は、血糖値を正常なレベルに下げることです。研究によると、血糖値を適切にコントロールすることで、心臓病、腎臓病、失明などの合併症を予防または遅らせることができることが示されています。
Q4. 2型糖尿病は通常どのように管理されていますか?
高血糖は、食事と運動、多くの経口薬、およびインスリン注射によって下げることができます.グルコヴァンス 2.50mg を服用する前に、まず運動と減量によって糖尿病のコントロールを試みてください。グルコヴァンスを服用している場合でも、運動を続け、糖尿病に推奨される食事に従う必要があります。
Q5.グルコヴァンス 400mg は、他の血糖コントロール薬とは異なる働きをしますか?
はい、そうです。グルコバンス400mgは、グリブリドとメトホルミンの2種類の血糖降下薬を配合。これらの 2 つの薬は、2 型糖尿病に見られるさまざまな代謝障害を改善するために一緒に働きます。グリブリドは、主に体自身のインスリンをより多く放出させることによって血糖値を下げ、メトホルミンは、部分的には、体が自分自身のインスリンをより効果的に使用するのを助けることによって血糖値を下げます.一緒に、それらはあなたがより良いグルコースコントロールを達成するのを助けるのに効率的です.
Q6.それでも血糖値が高すぎるとどうなりますか?
グルコヴァンスで十分に血糖値を下げることができない場合、医師はインスリン注射を処方するか、糖尿病をコントロールするための他の手段を講じます。
Q7.グルコヴァンス 400mg は副作用を引き起こす可能性がありますか?
GLUCOVANCE 2.50mg は、すべての血糖降下薬と同様に、一部の患者で副作用を引き起こす可能性があります。これらの副作用のほとんどは軽微です。ただし、GLUCOVANCE に関連する深刻ではあるがまれな副作用もあります (Q9 ~ Q13 を参照)。
Q8.グルコヴァンス 500mg の最も一般的な副作用は何ですか?
GLUCOVANCE 5mg の最も一般的な副作用は、通常、下痢、吐き気、胃のむかつきなどの軽微なものです。これらの副作用が発生する場合、通常は治療の最初の数週間で発生します。 GLUCOVANCE を食事と一緒に服用すると、これらの副作用を軽減するのに役立ちます。
まれに、立ちくらみ、めまい、震え、空腹などの低血糖(低血糖)の症状が発生することがあります。食事を抜いたり、アルコールを過剰に摂取したり、十分な食事を摂らずに激しい運動をしたりすると、低血糖症状のリスクが高まります。医師のアドバイスに従うことで、これらの症状を避けることができます。
Q9.グルコヴァンスに深刻な副作用はありますか?
グルコース-6-リン酸デヒドロゲナーゼ (G6PD) 欠乏症として知られる状態の人がグルコバンスを服用すると、溶血性貧血 (赤血球の急速な分解) が発生する可能性があります。 G6PD欠損症は通常、家族内で発生します。 GLUCOVANCE の服用を開始する前に、あなたまたはあなたの家族が G6PD 欠乏症と診断されている場合は、医師に相談してください。
GLUCOVANCE が重篤な副作用を引き起こすことはめったにありません。 GLUCOVANCE 2.50mg が引き起こす可能性のある最も深刻な副作用は、乳酸アシドーシスと呼ばれます。
Q10.乳酸菌とは何ですか?
乳酸アシドーシスは、血液中の乳酸の蓄積によって引き起こされます。メトホルミンに関連する乳酸アシドーシスはまれであり、主に腎臓が正常に機能していない人々に発生しています.乳酸アシドーシスは、1 年間にメトホルミンを服用している患者の約 33,000 人に 1 人で報告されています。まれではありますが、乳酸アシドーシスが発生した場合、最大で半分のケースで致命的となる可能性があります.
また、グルコヴァンスを服用する際には、肝臓が正常に機能していることが重要です。肝臓は血流から乳酸を除去するのに役立ちます。
医師はあなたの糖尿病を監視し、腎臓と肝臓が正常に機能していることを確認するために時々血液検査を行うことがあります.
グルコヴァンスが腎臓や肝臓に害を及ぼすという証拠はありません。
Q11.乳酸アシドーシスの危険因子は他にありますか?
腎臓と肝臓が健康である限り、グルコヴァンス 400mg の服用による乳酸アシドーシスの発症リスクは非常に低くなります。ただし、いくつかの要因は、腎臓や肝臓の機能に影響を与える可能性があるため、リスクを高める可能性があります.医師とリスクについて話し合う必要があります。
次の場合は、グルコヴァンス 400mg を服用しないでください。
- 腎臓や肝臓に慢性的な問題がある
- ジゴキシン(ラノキシン®)やフロセミド(ラシックス®)などの薬で治療されているうっ血性心不全がある
- アルコールを過度に飲む(常時または短期間の「どんちゃん騒ぎ」飲酒)
- 重度の脱水状態(大量の体液が失われている)
- 注射可能な造影剤を使用した特定のX線検査を受ける予定です
- あなたは手術を受けるつもりです
- 心臓発作、重度の感染症、脳卒中などの深刻な状態を発症した場合
- 80歳以上で腎機能検査を受けていない
Q12.乳酸アシドーシスの症状は?
症状には次のようなものがあります。異常な筋肉痛;呼吸困難;異常または予期しない胃の不快感;寒いです;めまいや立ちくらみを感じます。または突然、心拍が遅くなったり不規則になったりします。
このような症状に気づいた場合、または病状が急変した場合は、グルコバンス錠の服用を中止し、ただちに医師の診察を受けてください。乳酸アシドーシスは、病院で治療しなければならない緊急事態です。
Q13.乳酸アシドーシスのリスクを減らすために、医師は何を知る必要がありますか?
重度の嘔吐、下痢、および/または発熱を伴う病気にかかっている場合、または水分の摂取量が大幅に減少している場合は、医師に相談してください.これらの状況は重度の脱水につながる可能性があり、グルコバンス 400mg の服用を一時的に中止する必要がある場合があります。
造影剤の注入を必要とする手術や特殊な X 線処置を受ける予定がある場合は、医師に知らせてください。このような場合、GLUCOVANCE 2.50mg による治療を一時的に中止する必要があります。
Q14.グルコヴァンス 500mg は他の薬と一緒に服用できますか?
新しい薬が処方されたとき、またはすでに処方された薬の服用方法が変更されたときは、グルコヴァンス 2.50mg を服用していることを医師に伝えてください。 GLUCOVANCE 400mg は、一部の薬の作用を妨げる可能性があり、一部の薬は GLUCOVANCE の作用を妨げる可能性があります。
肺の血管内の高血圧である肺動脈性肺高血圧症(PAH)に使用されるボセンタンを服用している場合は、GLUCOVANCE を服用しないでください。
Q15.グルコヴァンス400mg服用中に妊娠したら?
妊娠を計画している場合、または妊娠したことがある場合は、医師に相談してください。他の経口血糖コントロール薬と同様に、妊娠中はグルコヴァンスを服用しないでください。
通常、医師は妊娠中にインスリンを処方します。すべての薬と同様に、授乳中の場合はグルコヴァンス 5mg の使用について医師と話し合う必要があります。
Q16.グルコヴァンスの飲み方は?
GLUCOVANCE 錠を何錠、どのくらいの頻度で服用するかについては、医師が説明します。これは、処方箋のラベルにも印刷する必要があります。低用量のグルコバンス 400mg から開始し、血糖値がコントロールされるまで徐々に用量を増やしていきます。
Q17.グルコヴァンス 400mg に関する詳しい情報はどこで入手できますか?
このリーフレットは、GLUCOVANCEに関する最も重要な情報をまとめたものです。質問や問題がある場合は、2 型糖尿病やグルコバンスとその副作用について、医師または他の医療提供者に相談してください。また、薬剤師が閲覧できる医療関係者向けのリーフレット(添付文書)もあります。

