Actos 15mg, 30mg Pioglitazone 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Actos とは何ですか? どのように使用されますか?
アクトス 15mg は、2 型糖尿病の症状を治療するために使用される処方薬です。アクトスは、単独で、または他の薬と併用して使用できます。
アクトスは糖尿病治療薬、チアゾリジンジオン薬です。
Actos 15mgが子供に安全で効果的かどうかは不明です.
Actos 15mg の副作用の可能性は何ですか?
Actos は、次のような重大な副作用を引き起こす可能性があります。
- 息切れ(特に横になっているとき)、
- 異常な疲労感
- 腫れ、
- 急激な体重増加、
- ピンクまたは赤の尿、
- 痛みや排尿困難、
- 排尿への新たな衝動または悪化する衝動、
- 視界が変わり、
- 手、腕、または足の突然の異常な痛み
上記の症状がある場合は、すぐに医療機関を受診してください。
アクトスの最も一般的な副作用は次のとおりです。
- 頭痛、
- 筋肉痛と、
- かぜの諸症状(鼻づまり、副鼻腔痛、くしゃみ、のどの痛み)
上記の症状がある場合は、すぐに医療機関を受診してください。
これらは、Actos の考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
警告
うっ血性心不全
- ACTOS 15mgを含むチアゾリジンジオンは、一部の患者でうっ血性心不全を引き起こしたり、悪化させたりする[参照 警告と注意事項 ]。
- ACTOS 30mg の開始後、および用量を増量した後は、心不全の徴候および症状 (例えば、過度の急激な体重増加、呼吸困難、および/または浮腫) について患者を注意深く監視してください。心不全が発生した場合は、現在の治療基準に従って管理し、ACTOS 15mg の中止または減量を検討する必要があります。
- ACTOS は、症候性心不全の患者には推奨されません。
- ニューヨーク心臓協会 (NYHA) で確立されたクラス III または IV の心不全を有する患者における ACTOS の開始は禁忌です [参照 禁忌 と 警告と注意事項 ]。
説明
ACTOS 錠剤はチアゾリジンジオンであり、経口抗糖尿病薬であるピオグリタゾンを含むペルオキシソーム増殖因子活性化受容体 (PPAR) ガンマのアゴニストです。
ピオグリタゾン [(±)-5-[[4-[2-(5-エチル-2-ピリジニル) エトキシ] フェニル] メチル]-2,4-] チアゾリジンジオン一塩酸塩は不斉炭素を 1 つ含み、化合物を合成して使用するラセミ混合物として。ピオグリタゾンの 2 つのエナンチオマーは、in vivo で相互変換します。 2 つのエナンチオマー間で薬理活性に違いは見られませんでした。構造式は次のとおりです。
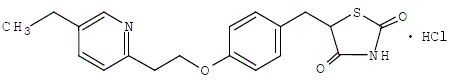
ピオグリタゾン塩酸塩は、C19H20N2O3S•HCl の分子式と 392.90 ダルトンの分子量を持つ無臭の白色結晶性粉末です。 N,Nジメチルホルムアミドに溶け、無水エタノールに溶けにくく、アセトンまたはアセトニトリルに極めて溶けにくく、水にほとんど溶けず、エーテルにほとんど溶けない。
ACTOS は、15 mg、30 mg、または 45 mg のピオグリタゾン (基剤として) を含む経口投与用の錠剤として入手できます。賦形剤として、ラクトス 30 mge 一水和物 NF、ヒドロキシプロピルセルロース NF、カルボキシメチルセルロース カルシウム NF、およびステアリン酸マグネシウム NF が配合されています。
適応症
単剤療法と併用療法
ACTOS 30mg は、複数の臨床現場で 2 型糖尿病の成人の血糖コントロールを改善するための食事と運動の補助として適応されます [参照 臨床研究 ]。
使用上の重要な制限
ACTOS 15mg は、内因性インスリンの存在下でのみ血糖降下作用を発揮します。 ACTOS 30mg は、1 型糖尿病または糖尿病性ケトアシドーシスの治療には使用しないでください。これらの状況では効果がないからです。
肝疾患のある患者には注意してください [参照 警告と注意事項 ]。
投薬と管理
すべての患者への推奨事項
アクトス 15mg は 1 日 1 回、食事に関係なく服用できます。
うっ血性心不全のない患者の推奨開始用量は、1 日 1 回 15 mg または 30 mg です。
うっ血性心不全 (NYHA クラス I または II) の患者の推奨開始用量は、1 日 1 回 15 mg です。
用量は、HbA1c によって決定される血糖反応に基づいて、1 日 1 回 15 mg 単位で最大 45 mg まで滴定できます。
ACTOS 30mg の開始後または増量後は、体重増加、浮腫、うっ血性心不全の徴候や症状などの体液貯留に関連する有害反応について、患者を注意深く監視してください。 ボックス警告 と 警告と注意事項 ]。
ACTOS を開始する前に、肝臓検査 (血清アラニンおよびアスパラギン酸アミノトランスフェラーゼ、アルカリホスファターゼ、および総ビリルビン) を取得する必要があります。肝疾患のない患者では、ACTOS 30mg による治療中の定期的な肝検査のモニタリングは推奨されません。 ACTOS の開始前に肝臓検査で異常があった患者、または ACTOS の服用中に肝臓検査で異常が見つかった患者は、警告と注意事項に記載されているとおりに管理する必要があります。 警告と注意事項 と 臨床薬理学 ]。
インスリン分泌促進薬またはインスリンとの併用
ACTOS 30mg とインスリン分泌促進薬(スルホニル尿素など)を併用した患者で低血糖が発生した場合は、インスリン分泌促進薬の投与量を減らす必要があります。
アクトス 30mg とインスリンを併用した患者で低血糖が発生した場合は、インスリンの投与量を 10% ~ 25% 減らす必要があります。インスリン投与量のさらなる調整は、血糖反応に基づいて個別化する必要があります。
強力な CYP2C8 阻害剤との併用
ACTOS 30mg と強力な CYP2C8 阻害剤であるゲムフィブロジルの同時投与により、ピオグリタゾンへの曝露が約 3 倍増加します。したがって、ゲムフィブロジルまたは他の強力な CYP2C8 阻害剤と組み合わせて使用する場合、ACTOS の最大推奨用量は 1 日 15 mg です。 薬物相互作用 と 臨床薬理学 ]。
供給方法
剤形と強度
丸錠には、次のピオグリタゾンが含まれています。
- 15 mg: ホワイトからオフホワイト、片面に「ACTOS」、もう片面に「15」のデボス加工
- 30 mg: ホワイトからオフホワイト、片面に「ACTOS」、もう片面に「30」のデボス加工
- 45 mg: ホワイトからオフホワイト、片面に「ACTOS」、もう片面に「45」のデボス加工
保管と取り扱い
アクトス 次のように、15 mg、30 mg、および 45 mg の錠剤があります。
15mg錠 白色からオフホワイト、丸型、凸型、刻み目のない錠剤で、片面に「ACTOS」、もう片面に「15」と記載されています。
NDC 64764-151-04 30本入りボトル NDC 64764-151-05 90本入りボトル NDC 64764-151-06 500本入りボトル
30mg錠 白色からオフホワイト、丸型、平型、スコアなしの錠剤で、片面に「ACTOS」、もう片面に「30」と記載されています。
NDC 64764-301-14 30本入りボトル NDC 64764-301-15 90本入りボトル NDC 64764-301-16 500本入りボトル
45mg錠 白色からオフホワイト、丸型、平型、スコアなしの錠剤で、片面に「ACTOS」、もう片面に「45」と記載されています。
NDC 64764-451-24 30本入りボトル NDC 64764-451-25 90本入りボトル NDC 64764-451-26 500本入りボトル
保管所
25°C (77°F) で保管してください。 15 ~ 30°C (59 ~ 86°F) [USP 制御室温を参照してください] まで許容されます。容器は密閉し、光、湿気、湿気を避けて保管してください。
販売元: Takeda Pharmaceuticals America, Inc. Deerfield, IL 60015. 改訂: 2017 年 12 月
副作用
次の重篤な有害反応は、ラベルの別の場所で説明されています。
- うっ血性心不全 [参照 ボックス警告 と 警告と注意事項 ]
- 浮腫[参照] 警告と注意事項 ]
- 骨折[参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
PROactive臨床試験でACTOS 30mgで治療された2型糖尿病および大血管疾患の2605人の患者を含む、8500人を超える2型糖尿病患者がランダム化二重盲検対照臨床試験でACTOSで治療されています。これらの試験では、6,000 人を超える患者が ACTOS で 6 か月以上治療され、4,500 人を超える患者が ACTOS 15mg で 1 年以上治療され、3,000 人を超える患者が少なくとも 2 年間 ACTOS で治療されています。
プールされた16~26週間のプラセボ対照単剤療法および16~24週間の追加併用療法の6つの試験では、有害事象による離脱の発生率は、ACTOS 30mgで治療された患者で4.5%、対照群で5.8%でした。治療を受けた患者。離脱につながる最も一般的な有害事象は、不適切な血糖コントロールに関連していましたが、これらの事象の発生率はプラセボ (3.0%) よりも ACTOS 30mg で低かった (1.5%)。
PROactive 試験では、有害事象による離脱の発生率は、ACTOS 30mg で治療された患者で 9.0%、プラセボで治療された患者で 7.7% でした。うっ血性心不全は、ACTOS 30mg で治療された患者の 1.3% とプラセボで治療された患者の 0.6% で発生した離脱につながる最も一般的な重篤な有害事象でした。
一般的な有害事象: 16 ~ 26 週間の単剤療法試験
表 1 は、ACTOS の 16 ~ 26 週間のプラセボ対照単剤療法の 3 つのプール試験で報告された一般的な有害事象の発生率とタイプの要約です。偽薬を投与された患者よりもACTOS 15mgで治療された患者で。これらの有害事象はいずれも、ACTOS の投与量に関連していませんでした。
一般的な有害事象: 16 週間から 24 週間のアドオン併用療法試験
ACTOS をスルホニル尿素に追加した試験で報告された一般的な有害事象の全体的な発生率と種類の概要を表 2 に示します。アクトスの用量。
メトホルミンへの ACTOS 30mg アドオンの試験で報告された一般的な有害事象の全体的な発生率と種類の概要を表 3 に示します。 ACTOSの試験用量。
表 4 は、ACTOS をインスリンに追加した試験で報告された一般的な有害事象の発生率と種類をまとめたものです。報告されている用語は、発生率が 5% を超え、より一般的にはテストされた最高用量の ACTOS で発生した用語を表しています。
PROactive 試験で報告された一般的な有害事象の全体的な発生率とタイプの要約を表 5 に示します。プラセボを受け取りました。
うっ血性心不全
うっ血性心不全に関連する有害事象の発生率の要約を、スルホニル尿素試験への 16 週間から 24 週間の追加試験、インスリン試験への 16 週間から 24 週間の追加試験、およびメトホルミン試験への 16 ~ 24 週間のアドオン。どのイベントも致命的ではありませんでした。
2 型糖尿病および NYHA クラス II または早期クラス III のうっ血性心不全の患者は無作為に割り付けられ、ACTOS 30 mg の 1 日用量 30 mg ~ 45 mg (n=262) またはグリブリドの 1 日用量のいずれかによる 24 週間の二重盲検治療を受けました。 10 mg から 15 mg (n=256)。この研究で報告されたうっ血性心不全に関連する有害事象の発生率の概要を表 7 に示します。
PROactive 試験中に発生した入院につながるうっ血性心不全イベントを表 8 にまとめます。
心臓血管の安全性
PROactive 試験では、2 型糖尿病と大血管疾患の病歴を持つ 5,238 人の患者が、標準治療に加えて、1 日 45 mg まで強制的に漸増された ACTOS (N=2,605) またはプラセボ (N=2,633) に無作為に割り付けられました。ほぼすべての患者 (95%) が心血管薬 (ベータ遮断薬、ACE 阻害薬、アンギオテンシン II 受容体遮断薬、カルシウム チャネル遮断薬、硝酸塩、利尿薬、アスピリン、スタチン、フィブラート) を受けていました。ベースライン時の患者の平均年齢は 62 歳、糖尿病の平均継続期間は 9.5 年、平均 HbA1c は 8.1% でした。追跡調査の平均期間は 34.5 ヶ月でした。この試験の主な目的は、大血管イベントのリスクが高い 2 型糖尿病患者の死亡率と大血管罹患率に対する ACTOS の効果を調べることでした。主要な有効性変数は、全死因死亡、サイレント MI を含む致命的でない心筋梗塞 (MI)、脳卒中、急性冠症候群、冠動脈バイパス移植を含む心臓インターベンション、または経皮的介入、足首より上の脚の主要な切断、および脚のバイパス手術または血行再建術。 ACTOS 15mg で治療された合計 514 人 (19.7%) の患者と 572 人 (21.7%) のプラセボ治療を受けた患者が、主要な複合エンドポイントから少なくとも 1 つのイベントを経験しました (ハザード比 0.90; 95% 信頼区間: 0.80、1.02; p=0.10 )。
このコンポジット内の最初のイベントの3年間の発生率について、ACTOSとプラセボの間に統計的に有意な差はありませんでしたが、ACTOSによる死亡率または総大血管イベントの増加はありませんでした。主要な複合エンドポイントに寄与する最初の発生数と個々のイベントの合計を表 9 に示します。
体重の増加
ACTOS 30mg を単独で、または他の抗糖尿病薬と組み合わせて使用すると、用量に関連した体重増加が起こります。体重増加のメカニズムは不明ですが、おそらく体液貯留と脂肪蓄積の組み合わせが関与しています。
表 10 および 11 は、16 ~ 26 週間の無作為化二重盲検単剤療法および 16 ~ 24 週間の併用追加療法試験および PROactive 試験における、ACTOS およびプラセボによる体重の変化をまとめたものです。
浮腫
ACTOS の服用によって誘発された浮腫は、ACTOS を中止すると元に戻ります。うっ血性心不全が併存していない限り、浮腫は通常入院を必要としません。 ACTOS 30 mg の臨床試験で発生した浮腫の有害事象の頻度と種類の概要を表 12 に示します。
肝臓への影響
現在までに、ACTOS 対照臨床試験データベースで ACTOS による肝毒性が誘発されたという証拠はありません。 ACTOS 15mg とグリブリドをメトホルミンおよびインスリン療法の追加として比較する 3 年間の無作為化二重盲検試験は、参照範囲の上限の 3 倍を超える血清 ALT 上昇の発生率を評価するために特別に設計されました。試験の最初の 48 週間は 8 週間、その後は 12 週間ごと。 ACTOS で治療された合計 3/1051 (0.3%) の患者と、グリブリドで治療された 9/1046 (0.9%) の患者が、基準範囲の上限の 3 倍を超える ALT 値を発現しました。現在までに、ACTOS 対照臨床試験データベースで ACTOS で治療された患者で、血清 ALT が参照範囲の上限の 3 倍を超え、対応する総ビリルビンが参照範囲の上限の 2 倍を超えた例はありません。重度の薬物誘発性肝障害の可能性を予測する組み合わせ。
低血糖症
ACTOS 15mg の臨床試験では、低血糖の有害事象が研究者の臨床的判断に基づいて報告されており、指先でのグルコース検査による確認は必要ありませんでした。
スルホニル尿素試験への 16 週間の追加投与では、報告された低血糖の発生率は、ACTOS 30 mg で 3.7%、プラセボで 0.5% でした。インスリンの 16 週間追加試験で報告された低血糖の発生率は、ACTOS 15 mg で 7.9%、ACTOS 30 mg で 15.4%、プラセボで 4.8% でした。
報告された低血糖の発生率は、スルホニル尿素試験への 24 週間の追加試験 (15.7% 対 13.4%) とインスリンへの 24 週間の追加試験 (47.8 % 対 43.5%)。
これらの 4 つの試験で 3 人の患者が低血糖のために入院しました。 3 人の患者全員が、24 週間のインスリン試験への追加で ACTOS 30 mg (0.9%) を投与されました。追加の 14 人の患者は、入院を必要としない重度の低血糖 (患者の通常の活動にかなりの干渉を引き起こすと定義) を報告しました。これらの患者は、ACTOS 45 mg とスルホニル尿素の併用 (n=2)、または ACTOS 30 mg または 45 mg とインスリンの併用 (n=12) を受けていました。
膀胱腫瘍
腫瘍は、2 年間の発がん性試験で雄ラットの膀胱に観察された [参照 非臨床毒性学 ]。 3 年間の PROactive 臨床試験中に、ACTOS に無作為に割り付けられた 2605 人中 14 人の患者 (0.54%) と、プラセボに無作為に割り付けられた 2633 人中 5 人 (0.19%) の患者が膀胱がんと診断されました。膀胱がんの診断時に治験薬への曝露が1年未満の患者を除外した後、ACTOS 15mgで6例(0.23%)、プラセボで2例(0.08%)でした。試験の完了後、ACTOS への曝露をほとんど追加せずに、患者の大部分を最大 10 年間観察しました。 13 年間の PROactive 追跡と観察追跡の両方で、膀胱がんの発生は、ACTOS またはプラセボに無作為に割り付けられた患者間で差はありませんでした (HR = 1.00; 95% CI: 0.59-1.72) [参照 警告と注意事項 ]。
実験室の異常
血液学的効果
アクトス 15mg は、ヘモグロビンとヘマトクリットの低下を引き起こす可能性があります。プラセボ対照単剤療法試験では、ACTOS で治療した患者の平均ヘモグロビン値は 2% から 4% 減少しましたが、プラセボで治療した患者ではヘモグロビンの平均変化が -1% から +1% 減少しました。これらの変化は、主に治療の最初の 4 ~ 12 週間以内に発生し、その後は比較的一定のままでした。これらの変化は、ACTOS 30mg 療法に関連する血漿量の増加に関連している可能性があり、臨床的に重大な血液学的影響と関連している可能性は低い.
クレアチンホスホキナーゼ
ACTOS 15 mg の臨床試験における血清クレアチンホスホキナーゼ (CPK) のプロトコールに指定された測定中に、CPK が基準範囲の上限の 10 倍を超える単独の上昇が、ACTOS で治療された 9 例 (0.2%) の患者で認められました (値2150 ~ 11400 IU/L) であり、比較治療を受けた患者はいません。これら9人の患者のうち6人は引き続きACTOS 15mgを投与され、2人の患者は投与の最終日にCPKの上昇が認められ、1人の患者は上昇のためにACTOSを中止しました.これらの上昇は、明らかな臨床的後遺症なしに解消されました。これらの事象とACTOS 30mg療法との関係は不明です。
市販後の経験
アクトスの承認後の使用において、以下の副作用が確認されています。これらの反応は、不確かな規模の集団から自発的に報告されるため、一般に、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることはできません。
- 視力低下を伴う糖尿病性黄斑浮腫の新規発症または悪化[参照 警告と注意事項 ]。
- 致命的および非致命的な肝不全 [参照 警告と注意事項 ]。
うっ血性心不全の市販後の報告は、既知の心疾患の有無にかかわらず、および併用インスリン投与の有無にかかわらず、ACTOSで治療された患者で報告されています。
市販後の経験では、異常に急速な体重の増加や、臨床試験で一般的に観察される以上の増加が報告されています.このような増加を経験した患者は、体液の蓄積と、過度の浮腫やうっ血性心不全などの量に関連する事象について評価する必要があります[参照 ボックス警告 と 警告と注意事項 ]。
薬物相互作用
強力な CYP2C8 阻害剤
CYP2C8 の阻害剤 (例えば、ゲムフィブロジル) は、ピオグリタゾンの曝露 (血清濃度-時間曲線または AUC の下の領域) と半減期 (t½) を大幅に増加させます。したがって、ゲムフィブロジルまたは他の強力な CYP2C8 阻害剤と組み合わせて使用する場合、ACTOS の最大推奨用量は 1 日 15 mg です。 投薬と管理 と 臨床薬理学 ]。
CYP2C8 インデューサー
CYP2C8 のインデューサー (リファンピンなど) は、ピオグリタゾンの曝露 (AUC) を大幅に減少させる可能性があります。したがって、ACTOS 30 mg による治療中に CYP2C8 の誘導物質が開始または中止された場合、ACTOS の 45 mg の最大推奨 1 日用量を超えずに、臨床反応に基づいて糖尿病治療の変更が必要になる場合があります [参照 臨床薬理学 ]。
トピラマート
ピオグリタゾンとその活性代謝物の曝露の減少は、ピオグリタゾンとトピラマートの併用投与で認められた[参照 臨床薬理学 ]。この減少の臨床的関連性は不明です。ただし、ACTOS とトピラマートを併用する場合は、患者の血糖コントロールが適切かどうかを監視してください。
警告
の一部として含まれています "予防" セクション
予防
うっ血性心不全
ACTOS 15mg は、他のチアゾリジンジオンと同様に、単独で使用した場合、または他の抗糖尿病薬と組み合わせて使用した場合に、用量に関連した体液貯留を引き起こす可能性があり、ACTOS 30mg をインスリンと組み合わせて使用した場合に最も一般的です。体液貯留は、うっ血性心不全を引き起こしたり、悪化させたりする可能性があります。患者は、うっ血性心不全の兆候と症状を観察する必要があります。うっ血性心不全が発生した場合は、現在の治療基準に従って管理し、ACTOS の中止または減量を検討する必要があります [参照 ボックス警告 、 禁忌 、 と 有害反応 ]。
低血糖症
ACTOS をインスリンまたは他の抗糖尿病薬 (特にスルホニル尿素などのインスリン分泌促進薬) と組み合わせて投与されている患者は、低血糖のリスクがある可能性があります。低血糖のリスクを軽減するために、併用する糖尿病治療薬の投与量を減らす必要があるかもしれません。 投薬と管理 ]。
肝臓への影響
ACTOS 15mgを服用している患者の致命的および非致命的な肝不全の市販後の報告がありましたが、その報告には考えられる原因を確立するのに必要な情報が不十分です.現在までに、ACTOS 30mg の対照臨床試験データベースには、薬物誘発性肝毒性の証拠はありません [参照 有害反応 ]。
型糖尿病の患者は、脂肪肝疾患または一時的なうっ血性心不全を伴う心疾患を患っている可能性があり、どちらも肝臓検査の異常を引き起こす可能性があり、他の形態の肝疾患も患っている可能性があり、その多くは治療または管理できます。したがって、ACTOS 療法を開始する前に、肝臓の検査パネル (血清アラニンアミノトランスフェラーゼ [ALT]、アスパラギン酸アミノトランスフェラーゼ [AST]、アルカリホスファターゼ、および総ビリルビン) を取得し、患者を評価することをお勧めします。肝臓検査に異常がある患者では、ACTOS 15mg は慎重に開始する必要があります。
疲労、食欲不振、右上腹部の不快感、暗色尿、黄疸など、肝臓の損傷を示す可能性のある症状を報告した患者では、速やかに肝臓検査を実施してください。この臨床状況では、患者の肝臓検査に異常が見られた場合 (参照範囲の上限の 3 倍を超える ALT)、ACTOS 15mg 治療を中断し、考えられる原因を確立するために調査を行う必要があります。これらの患者では、肝臓検査の異常について別の説明がない限り、ACTOS を再開しないでください。
血清 ALT が参照範囲の 3 倍を超え、血清総ビリルビンが参照範囲の 2 倍を超える患者は、別の病因がなく、重度の薬物性肝障害のリスクがあるため、ACTOS を再開するべきではありません。血清 ALT またはビリルビンの上昇が少なく、別の原因が考えられる患者の場合、ACTOS による治療は慎重に行うことができます。
膀胱腫瘍
腫瘍は、2 年間の発がん性試験で雄ラットの膀胱に観察された [参照 非臨床毒性学 ]。さらに、3 年間の PROactive 臨床試験中に、ACTOS 15mg に無作為に割り付けられた 2605 人中 14 人の患者 (0.54%) と、プラセボに無作為に割り付けられた 2633 人中 5 人 (0.19%) の患者が膀胱がんと診断されました。膀胱がんの診断時に治験薬への曝露が1年未満の患者を除外した後、ACTOS 30mgで6例(0.23%)、プラセボで2例(0.08%)でした。試験の完了後、ACTOS への曝露をほとんど追加せずに、患者の大部分を最大 10 年間観察しました。 13 年間の PROactive 追跡調査と観察追跡調査の両方で、ACTOS 30mg またはプラセボに無作為に割り付けられた患者の間で、膀胱がんの発生に違いはありませんでした (HR = 1.00; [95% CI: 0.59-1.72])。
ACTOS にさらされた患者の膀胱がんのリスクに関する所見は、観察研究によって異なります。 ACTOS 30mgに関連する膀胱がんのリスクの増加を発見しなかった人もいれば、発見した人もいました.
米国で実施された 10 年間の大規模な前向き観察コホート研究では、ACTOS に曝露したことのない糖尿病患者と比較して、ACTOS に曝露したことのある糖尿病患者の膀胱がんのリスクに統計的に有意な増加は見られませんでした (HR = 1.06 [95% CI 0.89-1.26 ]))。
英国のデータを使用して実施されたレトロスペクティブ コホート研究では、ACTOS への曝露と膀胱がんの間に統計的に有意な関連性があることがわかりました (HR: 1.63; [95% CI: 1.22-2.19])。
ACTOS 15mg の累積投与量または累積曝露期間と膀胱がんとの関連は、米国での 10 年間の観察研究を含むいくつかの研究では検出されませんでしたが、他の研究では検出されました。これらの研究やその他の研究に固有の一貫性のない所見と制限により、観察データの決定的な解釈が妨げられています。
ACTOS は、膀胱腫瘍のリスクの増加と関連している可能性があります。ピオグリタゾンが膀胱腫瘍の腫瘍プロモーターであるかどうかを判断するには、データが不十分です。
したがって、ACTOS は活動性膀胱がんの患者には使用すべきではなく、膀胱がんの既往歴のある患者では、ACTOS による未知のがん再発リスクに対する血糖コントロールの利点を考慮する必要があります。
浮腫
コントロールされた臨床試験では、プラセボで治療された患者よりも ACTOS 30mg で治療された患者でより頻繁に浮腫が報告され、用量に関連しています [ 有害反応 ]。市販後の経験では、浮腫の新たな発症または悪化の報告が寄せられています。
ACTOS 15mg は、浮腫のある患者には注意して使用する必要があります。 ACTOS を含むチアゾリジンジオンは体液貯留を引き起こす可能性があり、うっ血性心不全を悪化または引き起こす可能性があるため、ACTOS 30mg はうっ血性心不全のリスクがある患者には注意して使用する必要があります。 ACTOS で治療された患者は、うっ血性心不全の徴候と症状を監視する必要があります [参照 ボックス警告 、 うっ血性心不全 と 患者情報 ]。
骨折
PROactive (大血管イベントにおける前向きピオグリタゾン臨床試験) では、大血管疾患の既往がある 2 型糖尿病患者 5,238 人が ACTOS (N=2,605) に無作為に割り付けられ、1 日最大 45 mg まで強制的に漸増されました (N=2,633)。標準治療に加えて。平均 34.5 か月の追跡期間中、女性の骨折の発生率は、ACTOS 30mg で 5.1% (44/870)、プラセボで 2.5% (23/905) でした。この違いは、最初の 1 年間の治療後に認められ、研究期間中持続しました。女性患者で観察された骨折の大部分は、下肢および遠位上肢を含む非脊椎骨折でした。プラセボ (2.1%) と比較して、ACTOS (1.7%) で治療された男性では、骨折の発生率の増加は観察されませんでした。骨折のリスクは、患者、特にACTOSで治療された女性患者のケアにおいて考慮されるべきであり、現在のケア基準に従って骨の健康を評価し維持することに注意を払うべきです.
黄斑浮腫
黄斑浮腫は、ACTOSまたは別のチアゾリジンジオンを服用していた糖尿病患者の市販後の経験で報告されています.一部の患者はかすみ目または視力の低下を示しましたが、他の患者は通常の眼科検査で診断されました。
ほとんどの患者は、黄斑浮腫が診断された時点で末梢浮腫を持っていました。一部の患者は、チアゾリジンジオンの中止後に黄斑浮腫が改善しました。
糖尿病患者は、現在の治療基準に従って、眼科医による定期的な目の検査を受ける必要があります。何らかの視覚症状を訴える糖尿病患者は、患者の基礎疾患やその他の身体所見に関係なく、速やかに眼科医に紹介する必要があります[参照 有害反応 ]。
大血管転帰
ACTOS による大血管のリスク低減の決定的な証拠を確立する臨床研究はありません。
患者相談情報
FDA 承認の患者ラベリング ( 患者情報 )。
- 食事の指示を守り、定期的に血糖値とグリコシル化ヘモグロビンを検査するように患者に指示することが重要です。発熱、外傷、感染症、または手術などのストレスの期間中は、投薬の必要性が変化する可能性があるため、患者はすぐに医師の診察を受けるように注意する必要があります.
- 体重や浮腫の異常な急激な増加を経験したり、ACTOS の服用中に息切れやその他の心不全の症状を発症した患者は、これらの症状を直ちに医師に報告する必要があります。
- 原因不明の吐き気、嘔吐、腹痛、疲労、食欲不振、または尿の色が濃い場合は、肝毒性が原因である可能性があるため、ACTOS の服用を直ちに中止し、直ちに医師の診察を受けるよう患者に伝えてください。
- 膀胱がんが原因である可能性があるため、肉眼的血尿、または治療中に発生または増加する排尿障害または尿意切迫感などの他の症状の兆候があれば、速やかに報告するよう患者に伝えてください。
- ACTOS 15mg を 1 日 1 回服用するよう患者に伝えます。アクトス 15mg は、食事の有無にかかわらず服用できます。 1日に服用し忘れた場合、次の日に服用量を2倍にしてはいけません.
- インスリンまたは他の抗糖尿病薬との併用療法を使用する場合、低血糖のリスク、その症状と治療、および低血糖を発症しやすい状態について、患者とその家族に説明する必要があります。
- 他のチアゾリジンジオンと同様に、ACTOS 30mg による治療は、排卵への影響により閉経前の無排卵の女性の一部に意図しない妊娠をもたらす可能性があることを女性患者に知らせてください。 特定の集団での使用 ]。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
年間の発がん性試験が、オスとメスのラットで最大 63 mg/kg の経口用量で実施されました (mg/m2 に基づく最大推奨経口用量 45 mg の約 14 倍)。薬剤性腫瘍は雄ラットの膀胱を除いてどの臓器にも観察されませんでした。良性および/または悪性の移行上皮腫瘍が、雄ラットで 4 mg/kg/日以上 (mg/m2 に基づく最大推奨ヒト経口用量にほぼ等しい) で観察されました。雄ラットで観察された膀胱腫瘍の機序として、その後の刺激および過形成を伴う尿路結石が仮定された。食事の酸性化を利用して結石の形成を減らす雄ラットでの 2 年間の機構研究が 2009 年に完了しました。食事の酸性化は減少しましたが、膀胱の過形成変化は消失しませんでした。結石の存在は、ピオグリタゾンに対する過形成反応を悪化させましたが、過形成変化の主な原因とは見なされませんでした。
雄ラットの膀胱所見のヒトへの関連性を排除することはできません。
2 年間の発がん性試験も、100 mg/kg/日 (mg/m2 に基づくヒトの最大推奨経口用量の約 11 倍) までの経口用量で、雌雄のマウスで実施されました。どの臓器にも薬剤性腫瘍は観察されませんでした。
ピオグリタゾン塩酸塩は、Ames 細菌アッセイ、哺乳動物細胞前方遺伝子変異アッセイ (CHO/HPRT および AS52/XPRT)、CHL 細胞を使用した in vitro 細胞遺伝学アッセイ、不定期 DNA 合成アッセイを含む、一連の遺伝毒性試験で変異原性を示さなかった。 、および in vivo 小核アッセイ。
雄および雌のラットにおいて、交尾および妊娠前および妊娠中の毎日、最大 40 mg/kg のピオグリタゾン塩酸塩の経口用量 (mg/m2 に基づくヒトの最大推奨経口用量の約 9 倍) では、受胎能に対する悪影響は観察されませんでした。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性における ACTOS の限られたデータは、主要な先天性欠損症または流産の薬物関連リスクを判断するには不十分です。妊娠中の糖尿病のコントロールが不十分な場合、母体と胎児にリスクがあります。 臨床上の考慮事項 ]。
動物の繁殖研究では、体表面積に基づいて、ピオグリタゾンを妊娠中のラットとウサギに器官形成期にそれぞれ 45 mg の臨床用量の 5 倍と 35 倍までの量で投与した場合、発生への悪影響は観察されませんでした。 データ ]。
主要な先天性欠損症の推定背景リスクは、HbA1c が 7 を超える妊娠前糖尿病の女性で 6 ~ 10% であり、HbA1c が 10 を超える女性では 20 ~ 25% と高いと報告されています。示された集団の流産の推定背景リスクは不明です。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2 ~ 4% および 15 ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
妊娠中の糖尿病の管理が不十分であると、糖尿病性ケトアシドーシス、子癇前症、自然流産、早産、死産、分娩合併症のリスクが高まります。糖尿病のコントロールが不十分な場合、重大な先天性欠損症、死産、巨人児関連の罹患率の胎児のリスクが高まります。
データ
動物データ
器官形成期に妊娠したラットに投与されたピオグリタゾンは、20 mg/kg の用量 (45 mg の臨床用量の約 5 倍) では発生への悪影響を引き起こさなかったが、40 および 80 mg/kg では分娩を遅らせ、胎児の生存率を低下させた、または ≥体表面積によると、45mgの臨床用量の9倍。器官形成期にピオグリタゾンを投与された妊娠中のウサギでは、80 mg/kg (45 mg の臨床用量の約 35 倍) では有害な発達への影響は観察されませんでしたが、160 mg/kg では胎児の生存率が低下し、45 mg の臨床用量の約 69 倍になりました。用量、体表面積による。妊娠ラットが妊娠後期および授乳期にピオグリタゾンを投与された場合、体重の減少に起因する出生後の発育の遅延が、母体用量 10 mg/kg 以上、または体表面積で 45 mg 臨床用量の 2 倍以上の用量で発生しました。
授乳
リスクの概要
母乳中のピオグリタゾンの存在、母乳育児への影響、または乳生産への影響に関する情報はありません。ピオグリタゾンはラットのミルクに含まれています。ただし、泌乳生理学における種固有の違いにより、動物のデータは母乳中の薬物レベルを確実に予測できない場合があります。母乳育児の発達上および健康上の利点は、ACTOS 15 mg に対する母親の臨床的必要性、および ACTOS 30 mg または母体の基礎疾患による母乳育児への潜在的な悪影響と併せて考慮する必要があります。
生殖能力のある雌と雄
ACTOS による治療は、他のチアゾリジンジオンと同様に、一部の無排卵の女性に排卵をもたらす可能性があるため、閉経前の女性との意図しない妊娠の可能性について話し合う.
小児用
小児患者におけるACTOSの安全性と有効性は確立されていません。
ACTOS 15mg は、体液貯留やうっ血性心不全、骨折、膀胱腫瘍など、成人で観察される副作用に基づいて、小児患者への使用は推奨されません。 警告と注意事項 ]。
高齢者の使用
合計 92 人の患者 (15.2%) が ACTOS で治療され、16 ~ 26 週間の二重盲検、プラセボ対照、単剤療法の 3 つのプール試験で 65 歳以上、2 人の患者 (0.3%) が 75 歳以上でした。 2 つのプールされた 16 週間から 24 週間のスルホニル尿素追加試験では、ACTOS 30mg で治療された 201 人の患者 (18.7%) が 65 歳以上で、19 人 (1.8%) が 75 歳以上でした。メトホルミンへの 16 週間から 24 週間のアドオンをプールした 2 つの試験では、ACTOS で治療された 155 人の患者 (15.5%) が 65 歳以上、19 人 (1.9%) が 75 歳以上でした。 2 つのプールされた 16 ~ 24 週間のインスリン追加試験では、ACTOS で治療された 272 人の患者 (25.4%) が 65 歳以上、22 人 (2.1%) が 75 歳以上でした。
PROactive では、ACTOS で治療された 1068 人の患者 (41.0%) が 65 歳以上、42 人 (1.6%) が 75 歳以上でした。
ピオグリタゾンの薬物動態研究では、高齢患者と若年患者の間で薬物動態パラメーターに有意差は観察されませんでした [ 臨床薬理学 ]。
臨床経験では、高齢者 (65 歳以上) と若い患者の間で有効性と安全性の違いは確認されていませんが、75 歳以上の患者のサンプルサイズが小さいため、これらの結論は限定されています。
過剰摂取
対照臨床試験中に、ACTOS 30mg の過剰摂取の 1 例が報告されました。男性患者は 1 日 120 mg を 4 日間、その後 1 日 180 mg を 7 日間服用しました。患者は、この期間中の臨床症状を否定しました。
過剰投与の場合は、患者の臨床徴候や症状に応じて適切な支持療法を開始する必要があります。
禁忌
- NYHA クラス III または IV の心不全が確定している患者での開始 [参照 ボックス警告 ]。
- ピオグリタゾンまたは ACTOS のその他の成分に対する既知の過敏症のある患者に使用します。
臨床薬理学
作用機序
ACTOS 15mg は、その作用機序をインスリンの存在に依存するチアゾリジンジオンです。 ACTOS は、末梢および肝臓のインスリン抵抗性を低下させ、その結果、インスリン依存性のグルコース処理が増加し、肝臓のグルコース出力が減少します。ピオグリタゾンはインスリン分泌促進薬ではありません。ピオグリタゾンは、ペルオキシソーム増殖因子活性化受容体ガンマ (PPAR?) のアゴニストです。 PPAR受容体は、脂肪組織、骨格筋、肝臓などのインスリン作用に重要な組織に見られます。 PPARのアクティベーション?核受容体は、グルコースおよび脂質代謝の制御に関与する多くのインスリン応答性遺伝子の転写を調節します。
糖尿病の動物モデルでは、ピオグリタゾンは 2 型糖尿病などのインスリン抵抗性状態に特徴的な高血糖、高インスリン血症、および高トリグリセリド血症を軽減します。ピオグリタゾンによって引き起こされる代謝変化は、インスリン依存性組織の応答性の増加をもたらし、インスリン抵抗性の多数の動物モデルで観察されています。
ピオグリタゾンは(インスリン抵抗性を低下させることによって)循環インスリンの効果を高めるため、内因性インスリンを欠く動物モデルでは血糖値を下げません。
薬力学
臨床試験では、ACTOS 15mg がインスリン抵抗性患者のインスリン感受性を改善することが示されています。 ACTOS は、インスリンに対する細胞の応答性を高め、インスリン依存性のグルコース処理を増加させ、インスリンに対する肝臓の感受性を改善します。 2 型糖尿病患者では、ACTOS によるインスリン抵抗性の低下により、血漿グルコース濃度、血漿インスリン濃度、および HbA1c 値が低下します。対照臨床試験では、ACTOS は、スルホニル尿素、メトホルミン、またはインスリンと組み合わせて使用すると、血糖コントロールに相加効果がありました [参照 臨床研究 ]。
脂質異常のある患者は、ACTOS の臨床試験に含まれていました。全体として、ACTOS 15mg で治療された患者は、血清トリグリセリドの平均減少、HDL コレステロールの平均増加、LDL および総コレステロールの一貫した平均変化はありませんでした。 ACTOS による大血管の利点の決定的な証拠はありません [参照 警告と注意事項 と 有害反応 ]。
26 週間のプラセボ対照、用量範囲の単剤療法研究では、プラセボ群の平均増加と比較して、15 mg、30 mg、および 45 mg ACTOS 15 mg 投与群で平均血清トリグリセリドが減少しました。平均 HDL コレステロールは、プラセボで治療された患者よりも ACTOS 30mg で治療された患者で大幅に増加しました。プラセボと比較して、ACTOS で治療された患者の LDL および総コレステロールに一貫した差はありませんでした (表 14 を参照)。
他の 2 つの単剤療法研究 (16 週間および 24 週間) と、スルホニル尿素 (16 週間および 24 週間)、メトホルミン (16 週間および 24 週間) またはインスリン (16 週間および 24 週間) との併用療法研究では、結果は一般的に上記のデータと一致しています。
薬物動態
ACTOS 15mg を 1 日 1 回投与すると、ピオグリタゾンとその主要な活性代謝物である M-III (ピオグリタゾンのケト誘導体) および M-IV (ピオグリタゾンのヒドロキシル誘導体) の両方の定常状態の血清濃度が 7 日以内に達成されます。定常状態では、M-III および M-IV はピオグリタゾンの血清濃度以上の血清濃度に達します。定常状態では、健康なボランティアと 2 型糖尿病患者の両方で、ピオグリタゾンはピーク総ピオグリタゾン血清濃度 (ピオグリタゾンと活性代謝物) の約 30% から 50% を占め、総 AUC の 20% から 25% を占めています。
ピオグリタゾン、M-III および M-IV の Cmax、AUC、およびトラフ血清濃度 (Cmin) は、1 日あたり 15 mg および 30 mg の投与量に比例して増加しました。
吸収
ピオグリタゾンの経口投与後、ピオグリタゾンの Tmax は 2 時間以内でした。食事は Tmax を 3 ~ 4 時間遅らせますが、吸収の程度 (AUC) を変えません。
分布
単回投与後のピオグリタゾンの分布の平均見かけ体積 (Vd/F) は、0.63 ± 0.41 (平均 ± SD) L/kg 体重です。ピオグリタゾンは、主に血清アルブミンに対して、ヒト血清中で広範にタンパク質結合 (>99%) しています。ピオグリタゾンは他の血清タンパク質にも結合しますが、親和性は低くなります。 M-III と M-IV も、血清アルブミンに広く結合しています (>98%)。
代謝
ピオグリタゾンは、水酸化と酸化によって広範囲に代謝されます。代謝物はまた、部分的にグルクロニドまたは硫酸抱合体に変換されます。代謝物 M-III および M-IV は、ヒトにおける主要な循環活性代謝物です。
In vitro データは、複数の CYP アイソフォームがピオグリタゾンの代謝に関与していることを示しています。ピオグリタゾンには、CYP2C8 と、程度は低いものの CYP3A4 が含まれており、主に肝外の CYP1A1 を含むさまざまな他のアイソフォームからの追加の寄与があります。強力な CYP2C8 阻害剤であるゲムフィブロジルと組み合わせたピオグリタゾンの in vivo 研究では、ピオグリタゾンが CYP2C8 基質であることが示されました [ 投薬と管理 と 薬物相互作用 ]。 ACTOS 30mgで治療された患者で測定された尿中6β-ヒドロキシコルチゾール/コルチゾール比は、ピオグリタゾンが強力なCYP3A4酵素誘導剤ではないことを示しました.
排泄と排泄
経口投与後、ピオグリタゾン投与量の約 15% から 30% が尿中に回収されます。ピオグリタゾンの腎排泄はごくわずかであり、薬物は主に代謝産物およびその抱合体として排泄されます。経口投与量の大部分は、未変化のまま、または代謝物として胆汁中に排泄され、糞便中に排泄されると推定されます。
ピオグリタゾンとその代謝物 (M-III と M-IV) の平均血清半減期 (t1/2) は、それぞれ 3 ~ 7 時間と 16 ~ 24 時間の範囲です。ピオグリタゾンの見かけのクリアランス CL/F は、5 ~ 7 L/hr と計算されます。
腎障害
ピオグリタゾン、M-III、および M-IV の血清排出半減期は、中等度 (クレアチニン クリアランス [CLcr] 30 ~ 50 mL/分) および重度 (CLcr
肝障害
健康な対照と比較して、肝機能障害のある被験者 (Child-Turcotte-Pugh グレード B/C) は、ピオグリタゾンおよび総ピオグリタゾン (ピオグリタゾン、M-III、および M-IV) の平均 Cmax が約 45% 減少しましたが、平均 AUC 値。したがって、肝障害のある患者の用量調整は必要ありません。
ACTOS による肝不全の市販後の報告があり、臨床試験では一般に、血清 ALT が参照範囲の上限の 2.5 倍を超える患者は除外されています。肝疾患のある患者には注意してください [参照 警告と注意事項 ]。
高齢患者
健康な高齢者では、ピオグリタゾンの Cmax に有意差はありませんでしたが、AUC 値は若年者に比べて約 21% 高くなりました。ピオグリタゾンの平均 t1/2 も、若い被験者 (約 7 時間) と比較して、高齢の被験者 (約 10 時間) で延長されました。これらの変化は、臨床的に関連すると考えられる大きさではありませんでした。
小児患者
小児患者におけるピオグリタゾンの安全性と有効性は確立されていません。 ACTOS 15mg は、小児患者への使用は推奨されません [ 特定の集団での使用 ]。
性別
ピオグリタゾンの平均 Cmax 値と AUC 値は、男性と比較して女性で 20% から 60% 増加しました。対照臨床試験では、ベースラインからの HbA1c の減少は、一般に男性よりも女性の方が大きかった (HbA1c の平均差の平均は 0.5%)。血糖コントロールを達成するために治療は患者ごとに個別化する必要があるため、性別のみに基づく用量調整は推奨されません。
民族性
さまざまな民族グループ間の薬物動態データは入手できません。
薬物間相互作用
動物毒物学および/または薬理学
ピオグリタゾン塩酸塩を経口投与したマウス (100 mg/kg)、ラット (4 mg/kg 以上)、およびイヌ (3 mg/kg) で、心肥大が観察されています (人間の最大推奨経口摂取量の約 11、1、および 2 倍)。 mg/m2 に基づく、それぞれマウス、ラット、およびイヌの用量)。 1 年間のラット研究では、明らかな心機能障害による薬物関連の早期死亡が 160 mg/kg/日の経口用量で発生しました (mg/m2 に基づく最大推奨経口用量の約 35 倍)。心臓肥大は、8.9 mg/kg 以上の経口用量 (mg/m2 に基づく最大推奨ヒト経口用量の約 4 倍) のサルでの 13 週間の研究で見られましたが、経口用量での 52 週間の研究では見られませんでした。最大 32 mg/kg (mg/m2 に基づく最大推奨経口用量の約 13 倍)。
臨床研究
単剤療法
型糖尿病患者の単剤療法としての ACTOS の使用を評価するために、16 週間から 26 週間の 3 つのランダム化二重盲検プラセボ対照試験が実施されました。これらの試験では、ACTOS 15mg を最大 45 mg の用量で、またはプラセボを 1 日 1 回、合計 865 人の患者で試験しました。
26 週間の用量範囲単剤療法試験では、2 型糖尿病患者 408 人が無作為に 7.5 mg、15 mg、30 mg、45 mg の ACTOS、またはプラセボを 1 日 1 回投与されました。以前の糖尿病治療薬による治療は、二重盲検期間の 8 週間前に中止されました。 15 mg、30 mg、および 45 mg の ACTOS 30 mg による治療では、プラセボと比較して、エンドポイントで HbA1c および空腹時血漿グルコース (FPG) が統計的に有意に改善されました (図 1、表 17 を参照)。
図 1 は、この 26 週間の研究における HbA1c の変化の経時変化を示しています。
図 1. 26 週間のプラセボ対照用量範囲研究における HbA1c のベースラインからの平均変化 (観測値)
24 週間のプラセボ対照単剤療法試験では、2 型糖尿病患者 260 人が 2 つの強制漸増型 ACTOS 治療群のいずれか、または模擬漸増型プラセボ群に無作為に割り付けられました。以前の糖尿病治療薬による治療は、二重盲検期間の 6 週間前に中止されました。 1 つの ACTOS 15mg 治療群では、患者は 1 日 1 回 7.5mg の初期用量を投与されました。 4 週間後、用量は 1 日 1 回 15 mg に増量され、さらに 4 週間後、試験の残り (16 週間) の間、用量は 1 日 1 回 30 mg に増量されました。 2 番目の ACTOS 治療群では、患者は 1 日 1 回 15 mg の初期用量を受け取り、同様の方法で 1 日 1 回 30 mg および 1 日 1 回 45 mg に漸増されました。記述されているように、ACTOS 15mg による治療は、プラセボと比較してエンドポイントで HbA1c および FPG の統計的に有意な改善をもたらしました (表 18 を参照)。
16 週間の単剤療法試験では、2 型糖尿病患者 197 人が 1 日 1 回の ACTOS 30 mg またはプラセボによる治療に無作為に割り付けられました。以前の糖尿病治療薬による治療は、二重盲検期間の 6 週間前に中止されました。 30 mg の ACTOS による治療は、プラセボと比較してエンドポイントで HbA1c および FPG の統計的に有意な改善をもたらしました (表 19 を参照)。
併用療法
適切にコントロールされていない 2 型糖尿病患者 (HbA1c ≥8 %) スルホニル尿素、メトホルミン、またはインスリンによる現在の治療にもかかわらず。さらに、24 週間の無作為化二重盲検臨床試験を 3 件実施し、ACTOS 30 mg と ACTOS 45 mg の効果を評価しました。スルホニル尿素、メトホルミン、またはインスリンによる治療。以前の糖尿病治療は、単剤療法または併用療法であった可能性があります。
スルホニル尿素試験へのアドオン
ACTOS とスルホニル尿素を組み合わせた 2 つの臨床試験が実施されました。両方の研究には、単独または他の抗糖尿病薬と組み合わせて、任意の用量のスルホニル尿素を服用している 2 型糖尿病患者が含まれていました。他のすべての抗糖尿病薬は、研究治療を開始する少なくとも3週間前に中止されました。
最初の研究では、560 人の患者が無作為に割り付けられ、現行のスルホニル尿素レジメンに加えて 15 mg または 30 mg の ACTOS 30 mg またはプラセボを 1 日 1 回 16 週間投与されました。スルホニル尿素へのアドオンとしての ACTOS による治療は、スルホニル尿素へのプラセボアドオンと比較して、エンドポイントで HbA1c および FPG の統計的に有意な改善をもたらしました (表 20 を参照)。
つ目の試験では、702 人の患者が無作為に割り付けられ、現行のスルホニル尿素レジメンに加えて、ACTOS 30 mg または 45 mg を 1 日 1 回、24 週間投与されました。 HbA1c の 24 週目のベースラインからの平均減少は、30 mg の用量で 1.6%、45 mg の用量で 1.7% でした (表 21 を参照)。 24 週目のベースラインからの FPG の平均減少は、30 mg の用量で 52 mg/dL、45 mg の用量で 56 mg/dL でした。
ACTOS とスルホニル尿素の併用による治療効果は、スルホニル尿素の投与量に関係なく患者で観察されました。
メトホルミン試験へのアドオン
ACTOS 30mg とメトホルミンを併用した 2 つの臨床試験が実施されました。どちらの試験にも、2 型糖尿病患者がメトホルミン単独または他の抗糖尿病薬との併用で投与されていました。他のすべての抗糖尿病薬は、研究治療を開始する少なくとも3週間前に中止されました。
最初の試験では、328 人の患者が無作為に割り付けられ、現行のメトホルミンレジメンに加えて、1 日 1 回 16 週間、ACTOS 30 mg またはプラセボのいずれかを投与されました。メトホルミンへのアドオンとしての ACTOS 30mg による治療は、メトホルミンへのプラセボアドオンと比較して、エンドポイントで HbA1c および FPG の統計的に有意な改善をもたらしました (表 22 を参照)。
2 つ目の試験では、827 人の患者が無作為に割り付けられ、現在のメトホルミンレジメンに加えて、ACTOS 30mg 30mg または 45mg を 1 日 1 回 24 週間投与されました。 HbA1c の 24 週目のベースラインからの平均減少は、30 mg の用量で 0.8%、45 mg の用量で 1.0% でした (表 23 を参照)。 24 週目のベースラインからの FPG の平均減少は、30 mg の用量で 38 mg/dL、45 mg の用量で 51 mg/dL でした。
メトホルミンと組み合わせたACTOSの治療効果は、メトホルミンの投与量に関係なく患者で観察されました。
インスリン試験へのアドオン
ACTOS 15mg とインスリンを併用した 2 つの臨床試験が実施されました。どちらの試験も、単独または別の抗糖尿病薬と組み合わせてインスリンを投与している 2 型糖尿病患者を対象としていました。他のすべての抗糖尿病薬は、研究治療を開始する前に中止されました。最初の試験では、566 人の患者が無作為に割り付けられ、インスリン療法に加えて 15 mg または 30 mg の ACTOS 15 mg またはプラセボを 1 日 1 回 16 週間投与されました。インスリンへのアドオンとしての ACTOS 30mg による治療は、インスリンへのプラセボアドオンと比較して、エンドポイントで HbA1c および FPG の統計的に有意な改善をもたらしました (表 24 を参照)。各治療群のベースラインでの平均 1 日インスリン投与量は約 70 単位でした。大多数の患者 (全体で 75%、プラセボで治療された 86%、ACTOS 15 mg で治療された 77%、ACTOS 30 mg で治療された 61%) は、ベースラインから最後の研究訪問まで、1 日あたりのインスリン投与量に変化がありませんでした。インスリンの 1 日量のベースラインからの平均変化 (インスリン用量を変更していない患者を含む) は、ACTOS 15 mg で治療された患者で -3 単位、ACTOS 30 mg で治療された患者で -8 単位、および患者で -1 単位でした。プラセボで治療。
つ目の試験では、1 日あたり中央値 60 単位のインスリンを投与されている 690 人の患者が、現在のインスリン療法に加えて、30 mg または 45 mg の ACTOS を 1 日 1 回 24 週間投与されるように無作為に割り付けられました。 HbA1c の 24 週目のベースラインからの平均低下は、30 mg 投与で 1.2%、45 mg 投与で 1.5% でした。 24週目におけるFPGのベースラインからの平均減少は、30mg用量で32mg/dL、45mg用量で46mg/dLであった(表25を参照)。両治療群のベースラインでの平均 1 日インスリン投与量は約 70 単位でした。大多数の患者 (全体で 55%、ACTOS 30 mg で治療された患者の 58%、ACTOS 45 mg で治療された患者の 52%) は、ベースラインから最後の研究訪問まで、1 日あたりのインスリン投与量に変化がありませんでした。インスリンの 1 日量のベースラインからの平均変化 (インスリン用量を変更していない患者を含む) は、ACTOS 30 mg で治療された患者で -5 単位、ACTOS 45 mg で治療された患者で -8 単位でした。
インスリンと組み合わせたACTOSの治療効果は、インスリンの投与量に関係なく患者で観察されました。
患者情報
アクトス (ak-TOS) (ピオグリタゾン) 錠
ACTOS 15mg の服用を開始する前、および補充を受けるたびに、この投薬ガイドを注意深くお読みください。新しい情報があるかもしれません。この情報は、あなたの病状や治療について医師と話すことに代わるものではありません。アクトスについてご不明な点がございましたら、医師または薬剤師にご相談ください。
ACTOS について知っておくべき最も重要な情報は何ですか?
ACOS は、心不全の新規発症または悪化など、深刻な副作用を引き起こす可能性があります。
- アクトス 15mg は、体に余分な水分を保持させ (体液貯留)、むくみ (浮腫) と体重増加につながる可能性があります。余分な体液は、一部の心臓の問題を悪化させたり、心不全につながる可能性があります。心不全とは、心臓が十分に血液を送り出せないことを意味します
- 重度の心不全がある場合は、ACTOS を服用しないでください。
- 心不全の症状(息切れや腫れなど)がある場合は、症状が重くなくても、アクトスが合わない可能性があります。
次のいずれかがある場合は、すぐに医師に連絡してください。
- 特に足首や脚の腫れや体液貯留
- 特に横になっているときの息切れまたは呼吸困難
- 異常に速い体重増加
- 異常な疲労
ACOS には、他にも重大な副作用がある場合があります。 「ACTOS の考えられる副作用は何ですか?」を参照してください。
アクトスとは?
アクトス 15mg は、成人 2 型糖尿病患者の血糖(グルコース)コントロールを改善するために、食事と運動とともに使用される処方薬です。アクトスはピオグリタゾンと呼ばれる糖尿病治療薬で、単独で、または他の糖尿病治療薬と併用して服用できます。
ACTOS が 18 歳未満の子供に安全かつ効果的であるかどうかは不明です。ACTOS は子供への使用は推奨されません。
ACTOS は 1 型糖尿病患者向けではありません。
ACTOS 30mg は、糖尿病性ケトアシドーシス (血液または尿中のケトンの増加) の人には適していません。
アクトスを服用してはいけない人は?
「ACTOS 15mg について知っておくべき最も重要な情報は何ですか?」を参照してください。
次の場合は、ACTOS 15mg を服用しないでください。
- 重度の心不全がある
- アクトスの成分にアレルギーのある方。 ACTOS の成分の完全なリストについては、この投薬ガイドの最後を参照してください。
これらの条件のいずれかがある場合は、ACTOS を服用する前に医師に相談してください。
ACTOS 30mg を服用する前に医師に何を伝えるべきですか?
ACOS を服用する前に、次の場合は医師に相談してください。
- 心不全がある
- 1型(「若年」)糖尿病を患っているか、糖尿病性ケトアシドーシスを患っていた
- 眼の奥に腫れ(黄斑浮腫)を引き起こすタイプの糖尿病性眼疾患がある
- 肝臓に問題がある
- 膀胱がんを持っている、または持っていた
- 妊娠している、または妊娠する予定がある。 ACTOS 15mg が胎児に害を及ぼす可能性があるかどうかはわかっていません。妊娠中または妊娠を計画している場合は、妊娠中に血糖値をコントロールする最善の方法について医師に相談してください。
- 月経が定期的またはまったくない(「人生の変化」の前の)閉経前の女性です。 アクトス 30mg を服用すると、妊娠する可能性が高くなる可能性があります。 ACTOS の服用中は、避妊の選択肢について医師に相談してください。アクトスの服用中に妊娠した場合は、すぐに医師に相談してください
- 授乳中または授乳を計画している。 ACTOS が母乳に移行するかどうか、また赤ちゃんに害を及ぼす可能性があるかどうかはわかっていません。授乳中の血糖値をコントロールする最善の方法について、医師に相談してください。
服用しているすべての薬について医師に伝えてください 処方薬や市販薬、ビタミン、ハーブサプリメントを含みます。
ACTOS 30mg と他のいくつかの薬は互いに影響を与える可能性があります。 ACTOS 15mg または他の特定の薬の投与量を変更する必要がある場合があります。
服用している薬を知る。あなたの薬のリストを保管し、新しい薬を始める前に医師と薬剤師に見せてください.彼らは、ACTOS 15mgを他の薬と一緒に服用しても大丈夫かどうかを教えてくれます.
アクトス 15mg はどのように服用すればよいですか?
- ACTOS 15mg を医師の指示どおりに服用してください
- 医師は、ACTOS の投与量を変更する場合があります。医師の指示がない限り、ACTOS の用量を変更しないでください。
- ACTOS は、単独で、または他の糖尿病薬と一緒に処方される場合があります。これは、血糖値がどれだけうまく制御されているかによって異なります。
- アクトス 15mg を 1 日 1 回、食事の有無にかかわらず服用してください
- ACTOS 15mg を飲み忘れた場合は、医師の指示がない限り、次の用量を処方どおりに服用してください。翌日、一度に2回服用しないでください
- アクトスを飲みすぎた場合は、すぐに医師に連絡するか、最寄りの病院の緊急治療室に行ってください
- 発熱、感染症、事故、手術などで身体がストレスを受けている場合は、糖尿病薬の投与量を変更する必要がある場合があります。すぐに医師に連絡してください
- アクトスを服用している間は、食事と運動プログラムを継続し、定期的に血糖値をテストしてください
- 医師は、ACTOS の服用を開始する前と服用中に特定の血液検査を行う必要があります。
- また、医師はヘモグロビン A1C 検査を行って、ACTOS で血糖がどの程度コントロールされているかを確認する必要があります。
- ACTOS を服用している間は、医師が定期的に目をチェックする必要があります。
ACTOS の考えられる副作用は何ですか?
ACOS は、次のような重大な副作用を引き起こす可能性があります。
- 「ACTOS について知っておくべき最も重要な情報は何ですか?」を参照してください。
- 低血糖(低血糖)。 これは、食事を抜いたり、血糖を下げる別の薬を使用したり、特定の医学的問題を抱えている場合に発生する可能性があります.血糖値が低すぎると、立ちくらみ、めまい、震え、または空腹が起こることがあります.低血糖値が問題になる場合は、医師に連絡してください
- 肝臓の問題。 次の場合は、すぐに医師に連絡してください。
- 吐き気または嘔吐
- 胃痛
- 異常または原因不明の疲労
- 食欲減少
- 暗い尿
- 皮膚や白目が黄色くなる
- 膀胱がん。 アクトスを服用すると、膀胱がんになる可能性が高くなる可能性があります。膀胱がんの治療を受けている場合は、ACTOS 15mg を服用しないでください。以下の膀胱がんの症状がある場合は、すぐに医師に相談してください。
- 血または尿の赤い色
- 尿意の増加
- 排尿時の痛み
- 骨折(骨折)。 通常、女性では手、上腕、または足に発生します。骨を健康に保つ方法については、医師に相談してください。
- 目の奥の腫れ(黄斑浮腫)を伴う糖尿病性眼疾患。 視力に変化があった場合は、すぐに医師に相談してください。医師は定期的に目をチェックする必要があります
- 妊娠につながる女性の卵巣からの卵子の放出 (排卵)。 月経が規則的でない閉経前の女性がアクトスを服用すると、排卵が起こる可能性があります。これにより、妊娠の可能性を高めることができます
- 風邪のような症状(上気道感染症)
- 頭痛
- 副鼻腔感染症
- 筋肉痛
- 喉の痛み
ACTOS の最も一般的な副作用は次のとおりです。
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、ACTOS のすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
アクトス 15mg の保管方法を教えてください。
- ACTOS 15mg を 68°F ~ 77°F (20°C ~ 25°C) で保管してください。 ACTOS は元の容器に入れ、遮光して保管してください
- ACTOS ボトルをしっかりと密閉し、錠剤を乾燥した状態に保ちます
- アクトスとすべての薬は子供の手の届かないところに保管してください
ACTOS の安全で効果的な使用に関する一般情報
医薬品は、医薬品ガイドに記載されている以外の目的で処方されることがあります。処方されていない状態で ACTOS を使用しないでください。他の人があなたと同じ症状であっても、ACTOS を与えないでください。それらに害を及ぼす可能性があります。
この投薬ガイドは、ACTOS に関する最も重要な情報をまとめたものです。さらに詳しい情報が必要な場合は、医師に相談してください。医療従事者向けに書かれた ACTOS に関する情報については、医師または薬剤師にお尋ねください。詳細については、www.actos.com にアクセスするか、1-877-825-3327 までお電話ください。
アクトス15mgの成分は?
活性成分: ピオグリタゾン 不活性成分: ラクトス 15mge 一水和物、ヒドロキシプロピルセルロース、カルボキシメチルセルロース カルシウム、ステアリン酸マグネシウム
この医薬品ガイドは、米国食品医薬品局によって承認されています。

