Amaryl 1mg, 2mg, 4mg Glimepiride 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
Amaryl 1mg とは何ですか。また、どのように使用されますか?
Amaryl 4mg は、2 型糖尿病の症状を治療するために使用される処方薬です。アマリル 4mg は、単独で使用することも、他の薬と併用することもできます。
Amaryl 2mg は、抗糖尿病薬、スルホニル尿素と呼ばれる薬のクラスに属しています。
アマリルが子供に安全で効果があるかどうかはわかっていません.
Amaryl の可能な副作用は何であるか。
アマリルは、次のような重大な副作用を引き起こす可能性があります。
- 肌が白くなったり、黄ばんだり、
- 濃い色の尿、
- 錯乱、
- 弱さ、そして
- 熱
上記の症状がある場合は、すぐに医療機関を受診してください。
アマリルの最も一般的な副作用は次のとおりです。
- 頭痛、
- めまい、
- 弱点、
- 吐き気と
- 低血糖
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、アマリルの副作用のすべてではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
アマリルは、有効成分グリメピリドを含有する経口スルホニル尿素剤です。化学的に、グリメピリドは 1-[[p-[2-(3-エチル-4-メチル-2-オキソ-3-ピロリン-1-カルボキサミド) エチル]フェニル]スルホニル]-3-(トランス-4-分子量490.62のメチルシクロヘキシル)尿素(C24H34N4O5S)。グリメピリドは、白色から黄白色の結晶性で、無臭からほとんど無臭の粉末で、水にほとんど溶けません。構造式は次のとおりです。
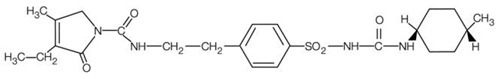
AMARYL 錠剤には、有効成分のグリメピリドと次の不活性成分が含まれています: 乳糖 (含水)、デンプングリコール酸ナトリウム、ポビドン、微結晶性セルロース、およびステアリン酸マグネシウム。さらに、AMARYL 1 mg 錠剤には酸化鉄赤色が含まれ、AMARYL 2 mg 錠剤には酸化鉄黄色と FD&C ブルー #2 アルミニウム レーキが含まれ、AMARYL 4 mg 錠剤には FD&C ブルー #2 アルミニウム レーキが含まれます。
適応症
AMARYL 2 mg は、2 型糖尿病の成人の血糖コントロールを改善するための食事と運動の補助として適応されます [参照 臨床研究 ]。
使用上の重要な制限
AMARYL は、1 型糖尿病または糖尿病性ケトアシドーシスの治療には効果がないため、使用しないでください。
投薬と管理
推奨用量
AMARYL 1mg は、朝食または 1 日の最初の主要な食事と一緒に投与する必要があります。
AMARYL の推奨開始用量は、1 日 1 回 1 mg または 2 mg です。低血糖のリスクが高い患者(高齢者や腎機能障害のある患者など)は、1 日 1 回 1 mg から開始する必要があります。 警告と注意事項 と 特定の集団での使用 ]。
日 2 mg の投与量に達した後、患者の血糖反応に基づいて、1 mg または 2 mg の増分でさらに投与量を増やすことができます。上昇は 1 ~ 2 週間ごとよりも頻繁に発生するべきではありません。低血糖のリスクが高い患者には、控えめな滴定スキームが推奨される[参照 警告と注意事項 と 特定の集団での使用 ]。
最大推奨用量は、1 日 1 回 8 mg です。
半減期の長いスルホニル尿素薬(クロルプロパミドなど)から AMARYL 1mg に移行する患者は、1 ~ 2 週間重複する薬物作用を示す可能性があり、低血糖を適切に監視する必要があります。
コレセベラムをグリメピリドと同時投与すると、最大血漿濃度とグリメピリドへの総暴露量が減少します。したがって、AMARYL 2mg は、コレセベラムの少なくとも 4 時間前に投与する必要があります。
供給方法
剤形と強度
AMARYL 4mg は、以下の錠剤として処方されています。
- 1mg(桃色、面平、横長、両脇に切り欠き、片面に「AMA RYL」刻印あり)
- 2mg(緑色、面平、長楕円形、両側に切り欠きあり、片面に「AMA RYL」と刻印)
- 4mg(青色、面平、両サイドに切り欠きのある長方形、片面に「AMA RYL」と刻印)
保管と取り扱い
アマリル 錠剤は、次の強度とパッケージ サイズで入手できます。
1mg (ピンク色、平らな面、側面に切り欠きのある長方形、片面に「AMA RYL」と刻印) 100 個入りのボトル ( NDC 0039-0221-10)
2mg (緑色、平らな面、側面に切り欠きのある長方形、片面に「AMA RYL」と刻印) 100 個入りのボトル ( NDC 0039-0222-10)
4mg (青色、平面、側面に切り欠きのある長方形、片面に「AMA RYL」と刻印) 100 本入り ( NDC 0039-0223-10)
25°C (77°F) で保管してください。 20 ~ 25°C (68 ~ 77°F) まで許容されるエクスカーション (参照 USP制御の室温 )。
安全栓を備えた密閉容器に分注してください。
sanofi-aventis US LLC, Bridgewater, NJ 08807, A SANOFI COMPANY. 2016 年 12 月改訂
副作用
以下の重篤な有害反応については、以下およびラベルの別の場所で詳しく説明しています。
- 低血糖 [参照 警告と注意事項 ]
- 溶血性貧血 [参照 警告と注意事項 ]
臨床試験では、AMARYL 4mg の最も一般的な副作用は、低血糖、めまい、無力症、頭痛、吐き気でした。
臨床試験の経験
臨床試験はさまざまな条件下で実施されるため、ある医薬品の臨床試験で観察された副作用率を別の医薬品の臨床試験で観察された率と直接比較することはできず、実際に観察された率を反映していない可能性があります。
約 2,800 人の 2 型糖尿病患者が、対照臨床試験で AMARYL 4mg で治療されました。これらの試験では、約 1,700 人の患者が AMARYL で少なくとも 1 年間治療されました。
表 1 は、11 のプールされたプラセボ対照試験で報告された、低血糖以外の有害事象を要約しています。治療期間は 13 週間から 12 か月の範囲でした。報告されている用語は、AMARYL 治療を受けた患者で 5% 以上の発生率で発生し、プラセボを受けた患者よりも一般的に発生した用語を表しています。
低血糖症
14 週間にわたる無作為二重盲検プラセボ対照単剤療法試験では、すでにスルホニル尿素療法を受けている患者が 3 週間のウォッシュアウト期間を経た後、AMARYL 1 mg、4 mg、8 mg、またはプラセボに無作為に割り付けられました。 AMARYL 4 mg または 8 mg に無作為に割り付けられた患者は、1 mg の初期用量からこれらの最終用量まで、忍容性に応じて強制漸増を受けました [参照 臨床研究 ]。低血糖の可能性(研究者が低血糖に関連している可能性があると考えた症状が少なくとも 1 つ存在することによって定義されます。同時のグルコース測定は必要ありませんでした)の全体的な発生率は、AMARYL 1 mg で 4%、AMARYL 4 mg で 17% でした。 AMARYL 8 mg では %、プラセボでは 0%。これらのイベントはすべて自己処理されました。
22 週間にわたるランダム化二重盲検プラセボ対照単剤療法試験で、患者は毎日 1 mg AMARYL またはプラセボの開始用量を受け取りました。 AMARYL 2mgの投与量は、90~150mg/dLの目標空腹時血漿グルコースに滴定されました。 AMARYL 2 mg の最終的な 1 日量は、1、2、3、4、6、または 8 mg でした [ 臨床研究 ]。 AMARYL とプラセボの全体的な低血糖の発生率 (14 週間の試験について上記で定義) は、19.7% 対 3.2% でした。これらのイベントはすべて自己処理されました。
体重の増加: AMARYL は、すべてのスルホニル尿素と同様に、体重増加を引き起こす可能性があります [ 臨床研究 ]。
アレルギー反応: 臨床試験では、そう痒症、紅斑、蕁麻疹、および胞状疱疹または斑状丘疹の発疹などのアレルギー反応が、AMARYL 治療を受けた患者の 1% 未満で発生しました。これらは、AMARYL による治療を継続しても解決する場合があります。より深刻なアレルギー反応(例、呼吸困難、低血圧、ショック)の市販後の報告がある[参照 警告と注意事項 ]。
臨床検査
上昇した血清アラニンアミノトランスフェラーゼ (ALT): AMARYL の 11 のプールされたプラセボ対照試験では、AMARYL で治療された患者の 1.9% とプラセボで治療された患者の 0.8% が参照範囲の上限の 2 倍を超える血清 ALT を発症しました。
市販後の経験
AMARYLの承認後の使用中に、次の副作用が確認されました。これらの反応は不確かな規模の集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません.
- アナフィラキシー、血管性浮腫、スティーブンス・ジョンソン症候群などの重篤な過敏症反応 [参照 警告と注意事項 ]
- G6PD 欠乏症の患者とない患者における溶血性貧血 [参照 警告と注意事項 ]
- 肝機能障害(例:胆汁うっ滞および黄疸を伴う)、ならびに肝不全に進行する可能性がある肝炎。
- 遅発性皮膚ポルフィリン症、光線過敏反応およびアレルギー性血管炎
- 白血球減少症、無顆粒球症、再生不良性貧血、汎血球減少症
- 血小板減少症(血小板数が10,000/μL未満の重症例を含む)および血小板減少性紫斑病
- 肝ポルフィリン反応およびジスルフィラム様反応
- 低ナトリウム血症および不適切な抗利尿ホルモン分泌症候群 (SIADH)、ほとんどの場合、他の薬を服用している患者、または低ナトリウム血症を引き起こしたり、抗利尿ホルモンの放出を増加させることが知られている病状を持っている患者に見られます。
- 味覚異常
- 脱毛症
薬物相互作用
グルコース代謝に影響を与える薬剤
多くの医薬品がグルコース代謝に影響を与えるため、AMARYL 4mg の用量調整が必要になる場合があり、特に低血糖や血糖コントロールの悪化を注意深く監視する必要があります。
以下は、AMARYL 2mg を含むスルホニル尿素のグルコース低下効果を高め、低血糖に対する感受性および/または強度を高める可能性のある薬剤の例です: 経口抗糖尿病薬、酢酸プラムリンチド、インスリン、アンギオテンシン変換酵素 (ACE) 阻害剤、 H2受容体拮抗薬、フィブラート、プロポキシフェン、ペントキシフィリン、ソマトスタチン類似体、同化ステロイドおよびアンドロゲン、シクロホスファミド、フェニルミドール、グアネチジン、フルコナゾール、スルフィンピラゾン、テトラサイクリン、クラリスロマイシン、ジソピラミド、キノロン、およびフルオキセチンなどのタンパク質結合性の高い薬物非ステロイド性抗炎症薬、サリチル酸塩、スルホンアミド、クロラムフェニコール、クマリン、プロベネシド、およびモノアミンオキシダーゼ阻害剤。 AMARYL を投与されている患者にこれらの薬剤を投与する場合は、患者の低血糖を綿密に監視してください。 AMARYL 2mg を服用している患者からこれらの薬剤を中止する場合は、患者の血糖コントロールが悪化していないか注意深く監視してください。
以下は、AMARYL を含むスルホニル尿素のグルコース低下効果を低下させ、血糖コントロールの悪化につながる可能性がある薬剤の例です: ダナゾール、グルカゴン、ソマトロピン、プロテアーゼ阻害剤、非定型抗精神病薬 (例えば、オランザピンおよびクロザピン)、バルビツレート、ジアゾキシド、下剤、リファンピン、チアジドおよび他の利尿薬、コルチコステロイド、フェノチアジン、甲状腺ホルモン、エストロゲン、経口避妊薬、フェニトイン、ニコチン酸、交感神経刺激薬(例、エピネフリン、アルブテロール、テルブタリン)、およびイソニアジド。 AMARYL 2mg を投与されている患者にこれらの薬剤を投与する場合は、患者の血糖コントロールが悪化していないか注意深く監視してください。 AMARYL 2mg を服用している患者からこれらの薬剤を中止する場合は、患者の低血糖を綿密に監視してください。
ベータブロッカー、クロニジン、およびレセルピンは、AMARYL のグルコース低下効果の増強または弱体化につながる可能性があります。
急性および慢性のアルコール摂取は、AMARYL 1mg のグルコース低下作用を予測不可能な形で増強または弱める可能性があります。
β遮断薬、クロニジン、グアネチジン、レセルピンなどの交感神経遮断薬を服用している患者では、低血糖の徴候が軽減または消失する場合があります。
ミコナゾール
重度の低血糖につながる経口ミコナゾールとスルホニル尿素との相互作用の可能性が報告されています。この相互作用がミコナゾールの他の剤形でも起こるかどうかは不明です。
シトクロム P450 2C9 相互作用
グリメピリドとシトクロム P450 2C9 の阻害剤(例、フルコナゾール)および誘導剤(例、リファンピン)との間に相互作用がある可能性があります。フルコナゾールはグリメピリドの代謝を阻害し、グリメピリドの血漿濃度を上昇させ、低血糖を引き起こす可能性があります。リファンピンはグリメピリドの代謝を誘発し、グリメピリドの血漿濃度を低下させ、血糖コントロールの悪化につながる可能性があります。
コレセベラムの同時投与
コレセベラムは、グリメピリドとグリメピリドを併用すると、最大血漿濃度と総曝露量を減らすことができます。ただし、コレセベラムの 4 時間前にグリメピリドを投与しても、吸収は減少しません。したがって、AMARYL はコレセベラムの少なくとも 4 時間前に投与する必要があります。
警告
の一部として含まれています 予防 セクション。
予防
低血糖症
AMARYL を含むすべてのスルホニル尿素は、重度の低血糖を引き起こす可能性があります。 有害反応 ]。低血糖の結果として、患者の集中力と反応力が損なわれる可能性があります。これらの障害は、運転や他の機械の操作など、これらの能力が特に重要な状況でリスクをもたらす可能性があります。重度の低血糖症は、意識消失または痙攣を引き起こし、脳機能の一時的または永続的な障害または死に至る可能性があります。
患者は、低血糖を認識して管理するよう教育を受けなければなりません。低血糖になりやすい患者(高齢者、腎機能障害のある患者、他の抗糖尿病薬を服用している患者など)が AMARYL 2mg の投与を開始および増量する場合は注意が必要です。衰弱または栄養失調の患者、および副腎、下垂体、または肝臓の機能障害のある患者は、特にグルコース低下薬の血糖降下作用を受けやすい.低血糖は、カロリー摂取量が不足している場合、激しいまたは長時間の運動の後、またはアルコールを摂取した場合にも発生する可能性が高くなります.
自律神経障害のある患者、高齢者、およびベータアドレナリン遮断薬または他の交感神経遮断薬を服用している患者では、低血糖の早期警告症状が異なるか、それほど顕著ではない可能性があります.これらの状況は、患者が低血糖に気付く前に重度の低血糖を引き起こす可能性があります。
過敏反応
アナフィラキシー、血管性浮腫、スティーブンス・ジョンソン症候群などの重篤な反応を含む、AMARYL で治療された患者の過敏症反応の市販後報告があります。過敏反応が疑われる場合は、直ちに AMARYL を中止し、反応の他の潜在的な原因を評価し、糖尿病の代替治療を開始してください。
溶血性貧血
スルホニル尿素は、グルコース 6-リン酸脱水素酵素 (G6PD) 欠乏症の患者に溶血性貧血を引き起こす可能性があります。 AMARYL 4mg はスルホニル尿素であるため、G6PD 欠乏症の患者には注意を払い、非スルホニル尿素の代替品の使用を検討してください。 G6PD欠乏症が知られていない、AMARYL 1mgを投与された患者における溶血性貧血の市販後の報告もある[参照 有害反応 ]。
スルホニル尿素薬による心血管死亡リスクの増加
経口血糖降下薬の投与は、食事のみまたは食事とインスリンによる治療と比較して、心血管死亡率の増加と関連していることが報告されています。この警告は、University Group Diabetes Program (UGDP) によって実施された研究に基づいています。この研究は、インスリン非依存性患者の血管合併症の予防または遅延における血糖降下薬の有効性を評価するために設計された長期前向き臨床試験です。糖尿病。この研究には、4 つの治療グループのいずれかにランダムに割り当てられた 823 人の患者が参加しました。食事のみで治療された患者のそれ。総死亡率の有意な増加は観察されませんでしたが、心血管死亡率の増加に基づいてトルブタミドの使用が中止されたため、研究が全体的な死亡率の増加を示す機会が制限されました.これらの結果の解釈に関する論争にもかかわらず、UGDP 研究の調査結果は、この警告の適切な根拠を提供します。患者には、AMARYL 4mg の潜在的なリスクと利点、および代替療法について説明する必要があります。この研究にはスルホニル尿素クラスの 1 つの薬剤 (トルブタミド) のみが含まれていましたが、安全性の観点から、この警告はこのクラスの他の経口血糖降下薬にも適用される可能性があると考えるのが賢明です。作用と化学構造。
大血管転帰
AMARYL やその他の抗糖尿病薬による大血管リスクの低減の決定的な証拠を確立する臨床研究はありません。
非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
30 か月間、完全飼料中に最大 5000 ppm の用量 (表面積に基づく、ヒトの最大推奨用量の約 340 倍) をラットに投与した研究では、発がんの証拠は示されませんでした。マウスでは、グリメピリドを 24 か月間投与すると、良性膵臓腺腫の形成が用量依存的に増加し、これは慢性的な膵臓刺激の結果であると考えられていました。完全飼料中 320 ppm、すなわち 46-54 mg/kg 体重/日の用量では、マウスに腺腫の形成は観察されなかった。これは、表面積に基づいて、1 日 1 回 8 mg という人間の最大推奨用量の約 35 倍です。
グリメピリドは一連の in vitro および in vivo 変異原性試験 (エームス試験、体細胞変異、染色体異常、不定期 DNA 合成、およびマウス小核試験) で変異原性を示さなかった。
グリメピリドは、2500 mg/kg 体重 (表面積に基づくヒトの最大推奨用量の 1,700 倍以上) まで暴露された動物の雄マウスの生殖能力に影響を与えませんでした。グリメピリドは、最大 4000 mg/kg 体重 (表面積に基づくヒトの最大推奨用量の約 4,000 倍) まで投与された雄および雌のラットの生殖能力に影響を与えませんでした。
特定の集団での使用
妊娠
妊娠カテゴリーC
妊娠中の女性における AMARYL 2mg の十分に管理された研究はありません。動物実験では、先天性異常の増加はありませんでしたが、ヒトの最大推奨用量(体表面積に基づく)の50倍(ラット)および0.1倍(ウサギ)のグリメピリド用量で、ラットおよびウサギで胎児死亡の増加が発生しました.この胎児毒性は、母体の低血糖を誘発する用量でのみ観察され、グリメピリドの薬理学的(血糖降下)作用に直接関係していると考えられており、他のスルホニル尿素でも同様に指摘されています. AMARYL は、潜在的な利益が胎児への潜在的なリスクを正当化する場合にのみ、妊娠中に使用する必要があります。妊娠中の異常な血糖値は先天性異常の発生率が高いことと関連していることをデータが示唆しているため、妊娠中の糖尿病治療では、血糖値をできるだけ正常に維持する必要があります。
非催奇形効果
分娩時にスルホニル尿素を投与された母親から生まれた新生児で、長期にわたる重度の低血糖(4~10日)が報告されています。
授乳中の母親
AMARYL 1mg が母乳中に排泄されるかどうかは不明です。ラットの出生前および出生後の研究では、有意な濃度のグリメピリドが母乳と子犬の血清に存在していました.妊娠中および授乳中に高レベルのグリメピリドに暴露されたラットの子孫は、出生後に上腕骨の短縮、肥厚、および屈曲からなる骨格奇形を発症しました。これらの骨格変形は、グリメピリドに曝露した母親の授乳の結果であると判断されました。これらの動物データと乳児の低血糖の可能性に基づいて、母親に対する AMARYL の重要性を考慮して、授乳を中止するか AMARYL 2mg を中止するかを決定する必要があります。
小児用
AMARYL 4mg の薬物動態、有効性、および安全性は、以下に示すように 2 型糖尿病の小児患者で評価されています。 AMARYL 4mg は、体重と低血糖に悪影響を与えるため、小児患者には推奨されません。
AMARYL 1 mg 単回投与の薬物動態は、10 歳から 17 歳までの 2 型糖尿病患者 30 人 (男性 = 7、女性 = 23) で評価されました。グリメピリドの平均 (± SD) AUC (339±203 ng·hr/mL)、Cmax (102±48 ng/mL)、および t½ (3.1±1.7 時間) は、成人の過去のデータ (AUC(0-last) ) 315±96 ng·hr/mL、Cmax 103±34 ng/mL および t½ 5.3±4.1 時間)。
小児患者における AMARYL の安全性と有効性は、2 型糖尿病患者 272 人 (8 ~ 17 歳) を AMARYL (n=135) またはメトホルミン (n=137) に無作為に割り付けた単盲検 24 週間試験で評価されました。 )。未治療の患者(無作為化前に少なくとも 2 週間、食事と運動のみで治療された患者)と以前に治療を受けた患者(少なくとも 3 か月間、他の経口抗糖尿病薬で治療された、または現在治療されている患者)の両方が参加資格がありました。研究登録時に経口抗糖尿病薬を投与されていた患者は、ウォッシュアウト期間なしで無作為化の前にこれらの薬物療法を中止しました。 AMARYL は 1 mg から開始し、12 週目までに 2、4 または 8 mg (平均最終用量 4 mg) まで漸増し、空腹時血糖値
24 週間後、AMARYL 4mg とメトホルミンの間の HbA1c の全体的な平均治療差は 0.2% で、メトホルミンが有利でした (95% 信頼区間 -0.3% ~ +0.6%)。これらの結果に基づいて、この試験は、メトホルミンと比較して AMARYL 4mg で HbA1c の同様の減少を示すという主な目的を達成しませんでした。
AMARYL 2mgで治療された小児患者の有害反応のプロファイルは、成人で観察されたものと同様でした[参照 有害反応 ]。
血糖値
高齢者の使用
AMARYL 2mg の臨床試験では、3491 人の患者のうち 1053 人 (30%) が 65 歳以上でした。これらの患者と若い患者の間で、安全性または有効性の全体的な違いは観察されませんでしたが、一部の高齢者の感度が高いことは除外できません。
65 歳以下の 2 型糖尿病患者 (n=49) と 65 歳以上 (n=42) の患者の間で、グリメピリドの薬物動態に有意差はなかった [ 臨床薬理学 ]。
グリメピリドは腎臓から実質的に排泄されます。高齢の患者さんは、腎機能が低下している可能性が高くなります。また、高齢者では低血糖に気づきにくいこともある[参照 投薬と管理 と 警告と注意事項 ]。この患者集団で AMARYL を開始し、AMARYL 1 mg の用量を増やす場合は注意してください。
腎障害
低血糖のリスクを最小限に抑えるために、AMARYL の推奨開始用量は、2 型糖尿病および腎障害のあるすべての患者に対して 1 日 1 mg です。 投薬と管理 と 警告と注意事項 ]。
型糖尿病と腎障害を持つ 16 人の患者を対象に、毎日 1 mg から 8 mg の範囲の用量を 3 か月間使用して、複数回用量滴定試験を実施しました。ベースラインのクレアチニン クリアランスは 10 ~ 60 mL/min の範囲でした。 AMARYL の薬物動態は複数回用量滴定試験で評価され、その結果は単回投与試験に登録された患者で観察された結果と一致していました。どちらの研究でも、腎機能が損なわれると AMARYL の相対的総クリアランスが増加しました。どちらの研究も、腎機能障害のある患者では 2 つの主要な代謝産物の排出が減少することを示しました [参照 臨床薬理学 ]。
過剰摂取
AMARYL 2mg の過剰摂取は、他のスルホニル尿素と同様に、重度の低血糖を引き起こす可能性があります。低血糖の軽度のエピソードは、経口ブドウ糖で治療できます。重度の低血糖反応は、即時の治療を必要とする医学的緊急事態を構成します。昏睡、発作、または神経障害を伴う重度の低血糖症は、グルカゴンまたは静脈内ブドウ糖で治療できます。明らかな臨床的回復後に低血糖が再発する可能性があるため、継続的な観察と追加の炭水化物摂取が必要になる場合がある[参照 警告と注意事項 ]。
禁忌
AMARYL は、以下に対する過敏反応の既往歴のある患者には禁忌です。
- グリメピリドまたは製品の成分のいずれか[参照 警告と注意事項 ]。
スルホンアミド誘導体: スルホンアミド誘導体に対してアレルギー反応を起こしたことのある患者は、AMARYL に対してアレルギー反応を起こす可能性があります。スルホンアミド誘導体に対するアレルギー反応の既往がある患者には、AMARYL 4mg を使用しないでください。
報告されている過敏症反応には、そう痒症を伴うまたは伴わない皮膚発疹、およびより深刻な反応(アナフィラキシー、血管性浮腫、スティーブンス・ジョンソン症候群、呼吸困難など)が含まれます。 警告と注意事項 と 有害反応 ]。
臨床薬理学
作用機序
グリメピリドは主に、膵臓のベータ細胞からのインスリンの放出を刺激することによって血糖を低下させます。スルホニル尿素は、膵臓ベータ細胞原形質膜のスルホニル尿素受容体に結合し、ATP 感受性のカリウム チャネルを閉じ、それによってインスリンの放出を刺激します。
薬力学
健康な被験者では、AMARYL の単回経口投与後、最大効果 (最小血糖値) に達するまでの時間は約 2 ~ 3 時間でした。 HbA1c、空腹時血糖、および食後血糖に対する AMARYL の効果は、臨床試験で評価されています [参照 臨床研究 ]。
薬物動態
吸収
健康な被験者にグリメピリドを単回経口投与した研究と、2 型糖尿病患者に複数回経口投与した研究では、投与後 2 ~ 3 時間でピーク薬物濃度 (Cmax) が示されました。グリメピリドを食事とともに投与した場合、平均 Cmax と AUC (曲線下面積) はそれぞれ 8% と 9% 減少しました。
グリメピリドは、複数回投与しても血清中に蓄積しません。グリメピリドの薬物動態は、健康な被験者と 2 型糖尿病患者の間で違いはありません。経口投与後のグリメピリドのクリアランスは、1 mg から 8 mg の用量範囲で変化せず、線形の薬物動態を示しています。
健康な被験者では、グリメピリドの薬物動態パラメーターの個人内および個人間の変動は、それぞれ 15 ~ 23% および 24 ~ 29% でした。
分布
健常者の静脈内投与後、分布容積 (Vd) は 8.8 L (113 mL/kg)、全身クリアランス (CL) は 47.8 mL/min でした。タンパク質結合は 99.5% を超えていました。
代謝
グリメピリドは、静脈内または経口投与後、酸化的生体内変化によって完全に代謝されます。主な代謝物は、シクロヘキシル ヒドロキシ メチル誘導体 (M1) とカルボキシル誘導体 (M2) です。シトクロム P450 2C9 は、グリメピリドから M1 への生体内変換に関与しています。 M1 はさらに、1 つまたは複数のサイトゾル酵素によって M2 に代謝されます。 M2 は非アクティブです。動物では、M1 はグリメピリドの薬理活性の約 3 分の 1 を持っていますが、M1 がヒトの血糖値に対して臨床的に意味のある効果をもたらすかどうかは不明です。
排泄
14C-グリメピリドを 3 人の健康な男性に経口投与したところ、7 日間で全放射能の約 60% が尿中に回収された。 M1 と M2 は、尿中に回収された放射能の 80 ~ 90% を占めていました。尿中の M1 と M2 の比率は、被験者 2 人で約 3:2、被験者 1 人で 4:1 でした。総放射能の約 40% が糞便から回収されました。 M1 と M2 は、糞便中に回収された放射能の約 70% (M1 と M2 の比率は 1:3) を占めていました。尿または糞便から親薬物は回収されませんでした。患者への静脈内投与後、グリメピリドまたはその M1 代謝物の有意な胆汁排泄は観察されませんでした。
高齢患者
65 歳以下の 2 型糖尿病患者と 65 歳以上の患者におけるグリメピリドの薬物動態の比較は、AMARYL 6 mg を毎日使用した複数回投与試験で評価されました。グリメピリドの薬物動態には、2 つの年齢層の間で有意差はありませんでした。年配の患者の定常状態での平均 AUC は、若い患者よりも約 13% 低かった。高齢患者の平均体重調整クリアランスは、若年患者よりも約 11% 高かった。
性別
体重の差を補正した場合、グリメピリドの薬物動態に男女差は認められなかった。
人種
人種がグリメピリドの薬物動態に及ぼす影響を評価する研究は実施されていませんが、2 型糖尿病患者における AMARYL 2mg のプラセボ対照試験では、HbA の減少は白人 (n = 536)、黒人 (n = 63) で同等でした。 、およびヒスパニック (n = 63)。
腎障害
クレアチニンクリアランス (CLcr) によって推定される軽度、中等度、および重度の腎障害を有する患者に AMARYL 3 mg を単回投与の非盲検試験で投与しました。 )、グループ II は中程度の腎障害 (CLcr = 20-50 mL/min) の 3 人の患者で構成され、グループ III は重度の腎障害 (CLcr
肝障害
AMARYL 1mg の薬物動態は肝障害のある患者で十分に評価されていないため、AMARYL 1mg の薬物動態に肝障害の影響があるかどうかは不明です。
肥満患者
グリメピリドとその代謝物の薬物動態は、正常体重または病的肥満の 2 型糖尿病患者 28 人を対象とした単回投与試験で測定されました。病的肥満患者におけるグリメピリドの tmax、クリアランス、および分布容積は正常体重群と同様であったが、病的肥満患者は正常体重の患者よりも Cmax および AUC が低かった。正常な患者と病的肥満患者のグリメピリドの平均 Cmax、AUC0-24、AUC0-∞ 値は、547 ± 218 ng/mL 対 410 ± 124 ng/mL、3210 ± 1030 時間・ng/mL 対 2820 ± 1110 でした。時間・ng/mL および 4000 ± 1320 時間・ng/mL 対 3280 ± 1360 時間・ng/mL です。
薬物相互作用
アスピリン: 無作為化、二重盲検、2 期間、クロスオーバー試験では、健康な被験者にプラセボまたはアスピリン 1 グラムを 1 日 3 回、合計 5 日間投与しました。各試験期間の 4 日目に、1 mg の AMARYL 4 mg を単回投与しました。 AMARYL 4mg の投与は、14 日間のウォッシュアウト期間で区切られました。アスピリンと AMARYL 4mg の同時投与により、平均グリメピリド AUC が 34% 減少し、平均グリメピリド Cmax が 4% 減少しました。
コルセベラム: コレセベラムとグリメピリドの同時投与により、グリメピリドの AUC0-∞ と Cmax がそれぞれ 18% と 8% 減少しました。コレセベラムの 4 時間前にグリメピリドを投与した場合、グリメピリドの AUC0-∞ と Cmax に有意な変化はなく、それぞれ -6% と 3% [参照 投薬と管理 と 薬物相互作用 ]。
シメチジンおよびラニチジン: 無作為化非盲検 3 ウェイ クロスオーバー試験では、健康な被験者に 4 mg の AMARYL 単独投与、AMARYL とラニチジン (150 mg を 1 日 2 回 4 日間、AMARYL 2 mg を 3 日目に投与)、または AMARYL のいずれかを投与しました。 2 mg シメチジン (4 日間、毎日 800 mg、AMARYL は 3 日目に投与)。シメチジンまたはラニチジンと AMARYL 4mg の単回 4mg 経口投与との同時投与は、グリメピリドの吸収と体内動態を有意に変化させませんでした。
プロプラノロール: 無作為化、二重盲検、2 期間、クロスオーバー研究では、健康な被験者にプラセボまたはプロプラノロール 40 mg を 1 日 3 回、合計 5 日間投与しました。 4 日目または各試験期間に、2 mg の AMARYL 4 mg を単回投与しました。 AMARYL 4mg の投与は、14 日間のウォッシュアウト期間で区切られました。プロプラノロールとアマリル 1mg の同時投与により、グリメピリドの Cmax、AUC、および T½ がそれぞれ 23%、22%、および 15% 有意に増加し、グリメピリドの CL/f が 18% 減少しました。尿からの M1 および M2 の回収率は変化しませんでした。
ワーファリン: 非盲検、双方向、クロスオーバー研究では、健康な被験者が 10 日間、毎日 4 mg の AMARYL 2 mg を摂取しました。 AMARYL 投与開始の 6 日前と AMARYL 投与の 4 日目に、25 mg のワルファリンを単回投与しました。 AMARYL の同時投与は、R-および S-ワルファリン鏡像異性体の薬物動態を変化させませんでした。ワルファリン血漿タンパク質結合に変化は観察されませんでした。 AMARYL 1mg は、ワルファリンに対する薬力学的反応を統計的に有意に減少させました。 AMARYL 治療中のプロトロンビン時間 (PT) 曲線下の平均面積と最大 PT 値の減少は、それぞれ 3.3% と 9.9% であり、臨床的に関連する可能性は低いです。
臨床研究
単剤療法
すでにスルホニル尿素療法で治療されている 2 型糖尿病の合計 304 人の患者が、AMARYL 1mg 単剤療法の安全性と有効性を評価する 14 週間の多施設無作為化二重盲検プラセボ対照試験に参加しました。患者はスルホニル尿素療法を中止し、その後 3 週間のプラセボ ウォッシュ アウト期間に入り、その後 4 つの治療グループのうちの 1 つに無作為化されました: プラセボ (n=74)、AMARYL 1 mg (n=78)、AMARYL 4 mg (n=76)、および AMARYL 8 mg (n = 76)。 AMARYL 4mg に無作為に割り付けられたすべての患者は、毎日 1mg を開始しました。 AMARYL 4 mg または 8 mg に無作為に割り付けられた患者は、無作為化された用量に達するまで、用量が許容される限り、毎週の間隔で AMARYL 2 mg の用量を最初は 4 mg に、次に 8 mg に盲検化され、強制的に滴定されました。 4 mg の用量に無作為に割り付けられた患者は、2 週目に割り当てられた用量に達しました。8 mg の用量に無作為に割り付けられた患者は、3 週目に割り当てられた用量に達しました。無作為化された用量レベルに達したら、患者は 14 週までその用量で維持されました。プラセボで治療された患者の約 66% が試験を完了したのに対し、グリメピリド 1 mg で治療された患者の 81%、グリメピリド 4 mg または 8 mg で治療された患者の 92% でした。プラセボと比較して、毎日 1 mg、4 mg、8 mg の AMARYL による治療は、プラセボと比較して統計的に有意な HbA1c の改善をもたらしました (表 3)。
未治療または過去に糖尿病治療で限られた治療を受けた合計 249 人の患者が無作為に割り付けられ、無作為化された多施設で AMARYL (n=123) またはプラセボ (n=126) のいずれかによる 22 週間の治療を受けました。 、二重盲検、プラセボ対照、用量漸増試験。 AMARYL の開始用量は 1 日 1 mg で、2 週間間隔で 90 ~ 150 mg/dL の目標 FPG まで漸増または漸減しました。 FPG と PPG の両方の血糖値が実験室で分析されました。 10 週間の用量調節の後、残りの 12 週間、患者は最適な用量 (1、2、3、4、6、または 8 mg) で維持されました。 AMARYL 2mg による治療は、プラセボと比較して HbA1c と FPG の統計的に有意な改善をもたらしました (表 4)。
患者情報
食事指導の遵守、定期的な運動プログラム、および定期的な血糖検査の重要性について患者に知らせます。
低血糖や体重増加など、AMARYL 1mg の潜在的な副作用について患者に知らせてください。
低血糖の症状と治療、低血糖になりやすい状態について説明します。低血糖の結果、集中力と反応力が損なわれる可能性があることを患者に知らせる必要があります。これは、運転や他の機械の操作など、これらの能力が特に重要な状況でリスクをもたらす可能性があります。
糖尿病患者は、妊娠中、妊娠を検討している場合、授乳中、または授乳を検討している場合は、医療提供者に知らせるようにアドバイスする必要があります。

