Prandin 0.5mg, 1mg, 2mg Repaglinide 使用法、副作用および投与量。 オンライン薬局の価格。 処方箋不要のジェネリック医薬品。
プランディン 2mg とは何ですか? どのように使用されますか?
プランディン 1mg は、2 型糖尿病の症状を治療するために使用される処方薬です。プランディンは、単独で使用することも、他の薬と併用することもできます。
プランディンは、抗糖尿病薬、マグリチニド誘導体と呼ばれる薬のクラスに属しています。
Prandin 1mgが子供に安全で効果的かどうかは不明です.
プランディンの考えられる副作用は何ですか?
プランジンは、次のような深刻な副作用を引き起こす可能性があります。
- 蕁麻疹、
- 呼吸困難、
- 顔、唇、舌、喉の腫れ、
- 上腹部の激しい痛みが背中に広がり、
- 吐き気、
- 嘔吐、
- 速い心拍数、
- 肌が白くなったり、黄ばんだり、
- 濃い色の尿、
- 熱、
- 錯乱、
- 弱点、
- 喉の痛み、
- あなたの目に燃える、
- 皮膚の痛みと
- その後、赤または紫の発疹が(特に顔や上半身に)広がり、水ぶくれや皮むけを引き起こします
上記の症状がある場合は、すぐに医療機関を受診してください。
プランディンの最も一般的な副作用は次のとおりです。
- 低血糖、
- 吐き気、
- 下痢、
- 頭痛、
- 背中の痛み、
- 関節痛など
- かぜの諸症状(鼻づまり、くしゃみ、のどの痛み)
気になる副作用や治らない副作用がある場合は、医師に相談してください。
これらは、プランディンの考えられるすべての副作用ではありません。詳細については、医師または薬剤師にお尋ねください。
副作用に関する医学的アドバイスについては、医師に連絡してください。 1-800-FDA-1088 で副作用を FDA に報告できます。
説明
プランディン(レパグリニド)は、グリニド系の経口血糖降下薬です。レパグリニド、S(+)2-エトキシ-4(2((3-メチル-1-(2-(1ピペリジニル)フェニル)-ブチル)アミノ)-2-オキソエチル)安息香酸は、経口スルホニル尿素インスリンとは化学的に無関係です分泌促進物質。
レパグリニドの構造式
レパグリニドは、分子式 C27H36N2O4 および分子量 452.6 の白色からオフホワイトの粉末です。プランディン錠には、0.5 mg、1 mg、または 2 mg のレパグリニドが含まれています。さらに、各錠剤には次の不活性成分が含まれています: リン酸水素カルシウム (無水)、微結晶性セルロース、トウモロコシデンプン、ポラクリリン カリウム、ポビドン、グリセロール (85%)、ステアリン酸マグネシウム、メグルミン、ポロキサマー。 1 mg と 2 mg の錠剤には、着色剤として酸化鉄 (それぞれ黄色と赤色) が含まれています。
適応症
PRANDIN は、2 型糖尿病の成人の血糖コントロールを改善するための食事と運動の補助として示されています。
使用制限
PRANDIN は、1 型糖尿病患者や糖尿病性ケトアシドーシスの治療には使用しないでください。
投薬と管理
推奨用量と管理
HbA1c が 8% 未満の患者の推奨開始用量は、毎食前に経口で 0.5 mg です。 HbA1c が 8% 以上の患者の開始用量は、毎食前に経口で 1 または 2 mg です。
推奨用量範囲は、食前に 0.5 mg から 4 mg で、1 日最大用量は 16 mg です。患者の用量は、十分な血糖コントロールが達成されるまで、各食事で 4 mg まで 2 倍にする必要があります。各用量調整後、反応を評価するために少なくとも1週間経過する必要があります。
食事の30分前にPRANDINを服用するように患者に指示してください。 PRANDIN 2mg は、患者の食事パターンの変化に応じて、1 日 2、3、または 4 回投与することができます。
食事を抜く患者には、低血糖のリスクを軽減するために、プランディン1mgの予定用量をスキップするよう患者に指示してください。低血糖を経験している患者では、PRANDIN 1mgの用量を減らす必要があります[参照 警告と注意事項 ]。
重度の腎障害のある患者
重度の腎機能障害 (CrCl = 20 ~ 40 mL/分) の患者では、毎食前に経口で PRANDIN 0.5 mg を開始します。血糖コントロールを達成するために必要に応じて、用量を徐々に滴定します。
薬物相互作用のための用量変更
強力な CYP3A4 または CYP2C8 阻害剤、または強力な CYP3A4 または CYP2C8 インデューサーを併用している患者では、投与量の調整が推奨されます。 薬物相互作用 、 臨床薬理学 ]。
ゲムフィブロジルとの併用は禁忌です。 禁忌 ]。
PRANDIN 2mg とクロピドグレルの併用は避けてください。併用が避けられない場合は、毎食前に 0.5 mg で PRANDIN を開始し、1 日総用量 4 mg を超えないようにする [ 薬物相互作用 、 臨床薬理学 ]。
シクロスポリンを投与されている患者では、PRANDIN 2 mg の 1 日総投与量 6 mg を超えないようにしてください。 薬物相互作用 、 臨床薬理学 ]。
供給方法
剤形と強度
- mg 錠剤 (黄色、円形、両凸の錠剤、片面に「745」、反対面に「C」の型押し)
- 2mg錠(片面に「747」、反対面に「C」と刻印されたピンク色の丸型両凸錠)
プランディン(レパグリニド)錠、1mg 、片面に「745」、もう片面に「C」と刻印された、黄色の丸い両凸の錠剤として提供されます。それらは次のように利用できます。
100本のボトル NDC 60846-882-01
プランディン(レパグリニド)錠、2mg は、片面に「747」、反対面に「C」と刻印された、ピンク色の丸い両凸錠として提供されます。それらは次のように利用できます。
100本のボトル NDC 60846-884-01
20° ~ 25°C (68° ~ 77°F) [USP 制御室温を参照] で保管してください。湿気から保護してください。ボトルはしっかりと閉めてください。
安全クロージャー付きの密閉容器に分注してください。
販売元: Amneal Specialty, a Division of Amneal Pharmaceuticals LLC Bridgewater, NJ 08807. 改訂: 2019 年 3 月
副作用
次の重篤な副作用は、ラベルの別の場所にも記載されています。
低血糖 [参照 警告と注意事項 ]
臨床試験の経験
臨床試験はさまざまなデザインの下で実施されるため、ある臨床試験で報告された有害反応率を別の臨床試験で報告された率と簡単に比較することはできず、臨床現場で実際に観察された率を反映していない可能性があります。
PRANDIN 1mg は、臨床試験中に 2931 人に投与されました。これらの 2 型糖尿病患者のうち、約 1,500 人が少なくとも 3 か月間、1,000 人が少なくとも 6 か月間、800 人が少なくとも 1 年間治療を受けています。これらの個人の大部分 (1228 人) は、5 つの 1 年間の実薬対照試験のうちの 1 つで PRANDIN を受けました。 1 年間で、PRANDIN 1 mg 患者の 13% が副作用のために中止されました。離脱につながる最も一般的な副作用は、高血糖、低血糖、および関連する症状でした。
表 1 は、12 ~ 24 週間の試験期間におけるプラセボと比較した PRANDIN 患者の一般的な副作用を示しています。
低血糖症
PRANDIN 1mgの臨床試験では、低血糖が最もよく観察される副作用です。軽度または中等度の低血糖が、プランディン 1mg で治療された患者の 31%、プラセボで治療された患者の 7% で発生しました [ 警告と注意事項 ]。
低血糖は、1228 人の PRANDIN 患者の 16%、417 人のグリブリド患者の 20%、および 81 人のグリピジド患者の 19% で 1 年間の対照試験で報告されました。症候性低血糖症のPRANDIN治療を受けた患者のうち、昏睡を発症したり、入院を必要とした患者はいませんでした。
24 週間のプラセボ対照試験では、経口血糖降下薬治療を受けていない患者と、ベースラインで HbA1c が 8% 未満の患者は、低血糖の頻度が高くなりました。
体重の増加
以前に経口血糖降下薬で治療された患者がプランディンに切り替えられた場合、体重の平均増加はありませんでした.プランディン0.5mgで治療され、以前にスルホニル尿素薬で治療されていない患者の平均体重増加は3.3%でした.
心血管イベント
対照比較臨床試験では、虚血を含む重篤な心血管系有害事象の発生率は、スルホニル尿素薬(13/498または3%)よりもPRANDIN(51/1228または4%)の方が高かった。
7件の対照臨床試験には、NPH-インスリンとのPRANDIN併用療法(n=431)、インスリン製剤単独(n=388)、または他の組み合わせ(スルホニル尿素とNPH-インスリンまたはPRANDIN 1mgとメトホルミン)(n=120)が含まれていました。 2 つの研究から、PRANDIN 0.5mg と NPH インスリンで治療された患者で 6 つの重篤な心筋虚血の有害事象があり、別の研究からインスリン製剤のみを使用している患者で 1 つの事象がありました。 警告と注意事項 ]。
チアゾリジンジオンとの併用療法
低血糖症
PRANDIN-ロシグリタゾンまたは PRANDIN-ピオグリタゾン併用療法の 24 週間の治療臨床試験中 (併用療法で合計 250 人の患者)、低血糖 (血糖値
末梢性浮腫および心不全
末梢性浮腫は、250 人中 12 人 (4.8%) の PRANDIN-チアゾリジンジオン併用療法患者と 124 人中 3 人 (2.4%) のチアゾリジンジオン単独療法患者で報告されました。 PRANDIN-チアゾリジンジオン療法で治療された 250 人の患者のうち 2 人 (0.8%) で、うっ血性心不全を伴う浮腫のエピソードが報告されました。両方の患者は冠動脈疾患の既往があり、利尿剤による治療後に回復しました。単剤療法群で同等の症例は報告されていません。
体重の増加
組み合わせ、PRANDIN およびピオグリタゾン療法に関連する平均体重増加は、それぞれ 5.5 kg、0.3 kg、および 2.0 kg でした。併用療法、PRANDIN 療法、およびロシグリタゾン療法に関連する平均体重増加は、それぞれ 4.5 kg、1.3 kg、および 3.3 kg でした。
まれな有害事象 (患者の 1% 未満)
臨床試験で観察されたあまり一般的ではない有害な臨床的または実験的事象には、肝酵素の上昇、血小板減少症、白血球減少症、およびアナフィラキシー様反応が含まれていました。
市販後の経験
PRANDINの承認後の使用中に、次の追加の副作用が確認されました。これらの反応は、不確かな規模の集団から自発的に報告されるため、一般に、その頻度や薬物曝露との因果関係を確実に推定することはできません。
- 脱毛症
- 溶血性貧血
- 膵炎
- スティーブンス・ジョンソン症候群
- 黄疸や肝炎などの重度の肝機能障害
薬物相互作用
PRANDINとの臨床的に重要な薬物相互作用
表 3 には、PRANDIN 1mg と併用して投与した場合に臨床的に重要な薬物相互作用を伴う薬物のリストと、それらを予防または管理するための指示が含まれています。
警告
の一部として含まれています "予防" セクション
予防
低血糖症
PRANDIN 0.5mg を含むすべてのグリニドは、低血糖を引き起こす可能性があります。 有害反応 ]。重度の低血糖は、発作を引き起こしたり、生命を脅かしたり、死に至ることがあります。低血糖は、集中力と反応時間を損なう可能性があります。これにより、これらの能力が重要な状況 (運転や他の機械の操作など) で個人や他の人が危険にさらされる可能性があります。
低血糖は突然発生する可能性があり、症状は個人によって異なり、同じ個人でも時間の経過とともに変化する可能性があります.長年の糖尿病患者、糖尿病性神経疾患の患者、交感神経系を遮断する薬(例えば、ベータ遮断薬)を使用している患者では、低血糖の自覚症状はそれほど顕著ではないかもしれません。 薬物相互作用 ]、または再発性の低血糖を経験する患者に。
低血糖のリスクを高める可能性のある要因には、食事パターンの変化(例、多量栄養素の含有量)、身体活動レベルの変化、併用薬の変更が含まれます [ 薬物相互作用 ]、および他の抗糖尿病薬との併用。腎障害または肝障害のある患者は、低血糖のリスクが高くなる可能性があります [参照 特定の集団での使用 ]。
患者は、食事の前にプランディン 0.5mg を投与し、食事を抜く場合はプランディンの投与量をスキップするように指示する必要があります。低血糖を経験している患者では、PRANDIN の投与量を減らす必要があります。 投薬と管理 ]。患者と介護者は、低血糖を認識して管理するための教育を受ける必要があります。血糖の自己監視は、低血糖の予防と管理において重要な役割を果たします。低血糖のリスクが高い患者および低血糖の自覚症状が低下している患者では、血糖モニタリングの頻度を増やすことが推奨されます。
NPH-インスリンとの併用による重篤な心血管有害反応
7つの対照試験全体で、2つの研究からのPRANDIN 0.5mgとNPH-インスリンで治療された患者で心筋虚血の6つの重大な有害事象があり、別の研究からのインスリン製剤のみを使用した患者で1つのイベントがありました[ 有害反応 ]。 PRANDIN は、NPH インスリンとの併用は推奨されていません。
大血管転帰
PRANDIN による大血管のリスク低減の決定的な証拠を確立する臨床研究はありません。

非臨床毒性学
発がん、突然変異誘発、生殖能力の障害
120 mg/kg/日までの用量でのラットにおける 104 週間の発がん性試験 (mg/m2 ベースで臨床暴露の約 60 倍) では、雄ラットで甲状腺および肝臓の良性腺腫の発生率が増加しました。雌のラットでは発がん性の証拠は見つかりませんでした。雄ラットにおける甲状腺腫瘍および肝臓腫瘍のより高い発生率は、それぞれ 30 mg/kg/日および 60 mg/kg/日の低用量では見られませんでした (これは、mg/m2 に対する臨床暴露のそれぞれ 15 倍および 30 倍以上です)。基本)。マウスでの 104 週間の発がん性試験で、500 mg/kg/日までの用量で、マウスに発がん性の証拠は見つかりませんでした (これは、mg/m2 ベースで臨床曝露の約 125 倍です)。
レパグリニドは一連の in vivo および in vitro 研究で非遺伝毒性であった: 細菌突然変異誘発 (Ames 試験)、V79 細胞における in vitro 前方細胞突然変異試験 (HGPRT)、ヒトリンパ球における in vitro 染色体異常試験、不定期および複製 DNA 合成ラット肝臓、in vivo マウスおよびラット小核試験。
ラットの受胎能試験では、レパグリニドがオスとメスのラットにそれぞれ最大 300 と 80 mg/kg/日の用量で投与されました。妊孕性への悪影響は観察されませんでした (これは、mg/m2 ベースで臨床暴露の 40 倍以上です)。
特定の集団での使用
妊娠
リスクの概要
妊娠中の女性における PRANDIN およびレパグリニドの使用に関する限られたデータは、主要な先天性欠損症または流産の薬物関連リスクを知らせるには不十分です。妊娠中の糖尿病のコントロールが不十分な場合、母体と胎児にリスクがあります。 臨床上の考慮事項 ]。
レパグリジンは、動物実験 (ラットおよびウサギ) で催奇形性がないことが示されました。胚毒性、ラット胎児の異常な四肢の発達が、妊娠の最終段階で高用量に暴露された雌ラットで観察されました。
主要な先天異常の推定背景リスクは、HbA1c が 7 を超える妊娠前糖尿病の女性では 6% から 10% であり、HbA1c が 10 を超える女性では 20% から 25% と高いと報告されています。示された集団の流産の推定背景リスクは不明です。米国の一般集団では、臨床的に認識された妊娠における主要な先天性欠損症および流産の推定背景リスクは、それぞれ 2% ~ 4% および 15% ~ 20% です。
臨床上の考慮事項
病気に関連する母体および/または胚/胎児のリスク
妊娠中の糖尿病の管理が不十分であると、糖尿病性ケトアシドーシス、子癇前症、自然流産、早産、死産、分娩合併症のリスクが高まります。糖尿病のコントロールが不十分な場合、重大な先天性欠損症、死産、巨人児関連の罹患率の胎児のリスクが高まります。
データ
ヒューマンデータ
妊娠中の女性における PRANDIN 2mg の使用に関連する発達上のリスクに関する適切なデータはありません。
動物データ
レパグリニドは、妊娠中の臨床曝露の 40 倍 (ラット) および約 0.8 倍 (ウサギ) の用量 (mg/m2 ベース) で、ラットまたはウサギにおいて催奇形性を示さなかった。妊娠 17 日から 22 日の間および授乳中に mg/m2 ベースで 15 倍の臨床暴露量でレパグリニドに暴露された母ラットの子孫は、出生後の上腕骨の短縮、肥厚、および屈曲からなる非催奇形の骨格奇形を発症した。この影響は、妊娠 1 日から 22 日までの臨床暴露量の 2.5 倍までの用量 (mg/m2 に基づく)、または妊娠 1 日から 16 日までの高用量では見られませんでした。
授乳
リスクの概要
母乳中の PRANDIN 0.5mg の存在、授乳中の乳児への影響、または乳生産への影響に関する情報はありません。レパグリニドはラットのミルクで検出されましたが、授乳生理学の種特異的な違いにより、動物のデータは母乳中の薬物レベルを確実に予測できない可能性があります.母乳育児の発育と健康上の利点は、母親の PRANDIN の臨床的必要性、および PRANDIN または母体の基礎疾患による母乳育児への潜在的な悪影響と併せて考慮する必要があります。
臨床上の考慮事項
レパグリニドが母乳中に排泄されるかどうかは不明ですが、この経路で排泄されることが知られている経口薬もあります。授乳中の乳児の低血糖の可能性が存在する可能性があり、授乳中の動物への影響のために、授乳中の母親でプランディンを中止するか、母親が授乳を中止するかを決定する必要があります. PRANDIN を中止し、食事だけでは血糖コントロールが不十分な場合は、インスリン療法を検討する必要があります。
データ
ラットの繁殖研究では、測定可能なレベルのレパグリニドが母動物の母乳で検出され、子犬で血糖値の低下が観察されました。相互育成研究は、骨格の変化を示した[参照 妊娠 ]は、子宮内で治療された仔よりも少ない程度であったが、治療された母動物によって育てられた対照の仔で誘発された可能性がある.
小児用
小児患者における安全性と有効性は確立されていません。
高齢者の使用
24 週間以上の臨床試験では、415 人の患者が 65 歳以上で、75 歳以上の患者はいませんでした。 1 年間の実薬対照試験では、これらの被験者と 65 歳未満の被験者の間で有効性または有害事象に差は見られませんでした。高齢の被験者では低血糖の頻度や重症度の増加は見られませんでしたが、一部の高齢者では低血糖に対する感受性が高くなっています。 PRANDIN 0.5mg 療法を除外することはできません。
腎障害
レパグリニドの薬物動態研究は、軽度から中等度の腎機能障害 (CrCl = 40 ~ 80 mL/min) および重度の腎機能障害 (CrCl = 20 ~ 40 mL/min) の患者で実施されました。軽度から中等度の腎機能障害のある患者では、初期用量調整は必要ありません。ただし、重度の腎機能障害のある患者は、0.5 mg の用量で PRANDIN 療法を開始し、慎重に滴定する必要があります [参照 投薬と管理 ]。
クレアチニンクリアランスが 20 mL/min 未満の患者、または血液透析を必要とする腎不全の患者では、研究は実施されませんでした。
肝障害
慢性肝疾患患者12人を対象に単回投与試験が実施されました。中等度から重度の肝機能障害を有する患者は、血清濃度がより高く、より長く続いた.したがって、肝機能障害のある患者では、PRANDIN 0.5mg を慎重に使用する必要があります。反応を完全に評価できるようにするには、用量調整の間隔を長くする必要がある場合があります。
過剰摂取
昏睡、発作、またはその他の神経学的障害を伴う重度の低血糖反応が発生し、緊急入院が必要な医療上の緊急事態となる可能性があります。意識消失や神経学的所見を伴わない低血糖症状は、ブドウ糖の経口摂取と、薬剤の投与量および/または食事パターンの調整により、積極的に治療する必要があります。医師が患者が危険にさらされていないことを確認するまで、綿密な監視を続けることができます。明らかな臨床的回復後に低血糖が再発する可能性があるため、最低 24 ~ 48 時間は患者を綿密に監視する必要があります。 PRANDIN が血液透析を使用して透析可能であるという証拠はありません。
禁忌
PRANDIN は、以下の患者には禁忌です。
- ゲムフィブロジルの併用 [参照 薬物相互作用 ]
- -レパグリニドまたは不活性成分に対する既知の過敏症
臨床薬理学
作用機序
レパグリニドは、膵臓からのインスリンの放出を刺激することにより、血糖値を低下させます。この作用は、膵島で機能しているベータ (β) 細胞に依存しています。インスリン放出はグルコース依存性であり、低グルコース濃度で減少します。
レパグリニドは、特徴的な部位に結合することにより、β細胞膜の ATP 依存性カリウム チャネルを閉じます。このカリウム チャネルの遮断により β 細胞が脱分極し、カルシウム チャネルが開きます。その結果、カルシウム流入が増加し、インスリン分泌が誘導されます。イオン チャネルのメカニズムは、組織選択性が高く、心臓や骨格筋への親和性が低い。
薬力学
型糖尿病患者 138 人を対象に、3 食ごとに 0.25 (承認された用量ではありません) から 4 mg の範囲の用量を使用して、4 週間の二重盲検プラセボ対照用量反応試験を実施しました。 PRANDIN 療法は、用量範囲全体にわたって用量に比例したグルコースの低下をもたらしました。血漿インスリンレベルは食事後に上昇し、次の食事の前にベースラインに戻りました.空腹時血糖降下効果のほとんどは、1~2週間以内に実証されました。
二重盲検、プラセボ対照、3 か月間の用量漸増研究では、各患者の PRANDIN 0.5mg またはプラセボの用量が毎週 0.25mg (承認された用量ではありません) から 0.5、1、および 2mg と最大値まで増加しました。空腹時血漿グルコース (FPG) レベルが 160 mg/dL 未満になるまで、または最大用量に達するまで、4 mg の用量で投与します。目標対照または最大用量を達成した用量を研究の終わりまで継続した。 FPG および食後 2 時間血糖値 (PPG) は、プラセボを投与された患者で増加し、レパグリニドで治療された患者で減少しました。レパグリニド治療群とプラセボ治療群の差は、-61 mg/dL (FPG) と -104 mg/dL (PPG) でした (表 4)。
食事に関連するインスリン放出と比較したプランディン0.5mgの投与量は、58人の患者を含む3つの試験で研究されました.食事と投薬パターンを変えた期間中 (1 日 2、3、または 4 食; 食前 x 2、3、または 4) の期間中、血糖コントロールは維持されました (食前×3)。食事開始時、食事の15分前、食事の30分前にプランディン0.5mgを投与した場合、血糖降下作用に差はありませんでした。
薬物動態
レパグリニドの薬物動態パラメータは、健常者を対象とした単回投与のクロスオーバー試験、および 2 型糖尿病患者を対象とした複数回投与の並行用量比例(0.5、1、2、および 4 mg)試験から得られたもので、表にまとめられています。これらのデータは、レパグリニドが血清中に蓄積しなかったことを示しています。経口レパグリニドのクリアランスは、0.5 ~ 4 mg の用量範囲で変化せず、用量と血漿薬物レベルとの間に線形関係があることを示しています。
吸収
経口投与後、レパグリニドは消化管から完全に吸収されます。健康な被験者または患者への単回および複数回の経口投与後、ピーク血漿薬物レベル (Cmax) は 1 時間 (Tmax) 以内に発生します。レパグリニドは、約 1 時間の半減期で血流から排出されます。平均絶対バイオアベイラビリティは 56% です。レパグリニドを食事とともに投与した場合、平均 Tmax は変化しませんでしたが、平均 Cmax と AUC (時間/血漿濃度曲線下面積) はそれぞれ 20% と 12.4% 減少しました。
分布
健康な被験者に静脈内 (IV) 投与した後、定常状態 (Vss) での分布容積は 31 L、全身クリアランス (CL) は 38 L/h でした。タンパク質結合およびヒト血清アルブミンへの結合は 98% を超えていました。
代謝と排泄
レパグリニドは、IV または経口投与後、酸化的生体内変化およびグルクロン酸との直接抱合によって完全に代謝されます。主な代謝物は、酸化ジカルボン酸 (M2)、芳香族アミン (M1)、およびアシル グルクロニド (M7) です。シトクロム P-450 酵素系、具体的には 2C8 および 3A4 は、レパグリニドの M2 への N-脱アルキル化および M1 へのさらなる酸化に関与することが示されています。代謝産物は、レパグリニドのグルコース低下効果には寄与しません。 14C-レパグリニドを 1 回経口投与してから 96 時間以内に、放射性標識の約 90% が糞便から回収され、約 8% が尿から回収されました。投与量のわずか 0.1% が親化合物として尿中に排出されます。主要代謝物 (M2) は、投与量の 60% を占めていました。親薬物の 2% 未満が糞便中に回収されました。レパグリニドは、活性肝取り込みトランスポーター (有機陰イオン輸送タンパク質 OATP1B1) の基質であると思われます。
ばく露の変動性
各食事で 0.25 ~ 4 mg を複数回投与した後のレパグリニドの AUC は、広範囲にわたって変化します。個人内および個人間の変動係数は、それぞれ 36% および 69% でした。治療用量範囲での AUC には 69 ~ 1005 ng/mL*hr が含まれていましたが、用量漸増試験では明らかな悪影響なしに最大 5417 ng/mL*hr の AUC 曝露に達しました。
特定の集団
高齢者
健康なボランティアは、3回の食事のそれぞれの前に2mgのPRANDIN 0.5mgのレジメンで治療されました. 65 歳未満の患者群と 65 歳以上の同程度の人数の患者群との間で、レパグリニドの薬物動態に有意差は認められなかった [ 特定の集団での使用 ]。
性別
男性と女性の薬物動態の比較では、0.5 mg から 4 mg の用量範囲で AUC が 2 型糖尿病の女性で 15% から 70% 高いことが示されました。この違いは、低血糖エピソード (男性: 16%; 女性: 17%) やその他の有害事象の頻度には反映されませんでした。
人種
人種の影響を評価するための薬物動態研究は実施されていませんが、2 型糖尿病患者を対象とした米国での 1 年間の研究では、血糖降下効果は白人 (n=297) とアフリカ系アメリカ人 (n= 33)。米国の用量反応研究では、白人 (n=74) とヒスパニック系 (n=33) の間で曝露 (AUC) に明らかな違いはありませんでした。
腎障害
レパグリニドの単回投与と定常状態での薬物動態を、2 型糖尿病で正常な腎機能 (CrCl > 80 mL/min)、軽度から中等度の腎機能障害 (CrCl = 40 ~ 80 mL/min)、および重度の腎機能障害の患者間で比較しました。腎機能障害 (CrCl = 20 ~ 40 mL/分)。レパグリニドの AUC と Cmax は、腎機能が正常な患者と軽度から中程度の障害のある患者で類似していました (平均値は、それぞれ 56.7 ng/mL*hr 対 57.2 ng/mL*hr および 37.5 ng/mL 対 37.7 ng/mL)。腎機能が著しく低下した患者では、平均 AUC 値と Cmax 値が上昇しました (それぞれ 98.0 ng/mL*hr と 50.7 ng/mL) が、この研究では、レパグリニド レベルとクレアチニン クリアランスの間に弱い相関しか示されませんでした。
肝障害
12 人の健常者と 12 人の慢性肝疾患 (CLD) 患者 (Child-Pugh スケールとカフェインクリアランスで分類) を対象に、単回投与の非盲検試験を実施しました。中等度から重度の肝機能障害を有する患者は、健康な被験者よりも総レパグリニドと非結合レパグリニドの両方の血清濃度が高く、より長く続きました (AUChealthy : 91.6 ng/mL*hr; AUCCLD 患者: 368.9 ng/mL*hr; Cmax, health : 46.7 ng/mL; Cmax、CLD 患者: 105.4 ng/mL)。 AUC は、カフェインクリアランスと統計的に相関していました。患者グループ全体でグルコースプロファイルの違いは観察されませんでした。
薬物間相互作用
健康なボランティアで実施された薬物相互作用研究は、PRANDIN 0.5mg がジゴキシン、テオフィリン、またはワルファリンの薬物動態特性に臨床的に関連する影響を及ぼさなかったことを示しています。シメチジンと PRANDIN 1mg の同時投与は、レパグリニドの吸収と体内動態を有意に変化させませんでした。
さらに、健康なボランティアを対象に、以下の薬物を PRANDIN と併用して研究しました。
臨床研究
単剤療法試験
24 週間治療を受けた 362 人の患者を対象に、二重盲検プラセボ対照試験が実施されました。試験終了時の PRANDIN 投与群(1 mg 群と 4 mg 群を合わせたもの)の HbA1c は、未治療患者および以前に経口血糖降下薬で治療した患者のプラセボ投与群と比較して、2.1% および 1.7% 減少しました。それぞれ。この固定用量試験では、経口血糖降下薬による治療を受けていない患者と、ベースラインで HbA1c が 8% 未満の患者が、より大きな血糖降下を示しました。
併用試験
プランディンとメトホルミンの併用
PRANDIN は、運動、食事、およびメトホルミン単独では十分にコントロールされていない 83 人の患者において、メトホルミンと組み合わせて研究されました。 PRANDIN 2mg の投与量は 4~8 週間で滴定され、その後 3 か月の維持期間が続きました。 PRANDIN 1mg とメトホルミンの併用療法は、PRANDIN 2mg またはメトホルミン単独療法と比較して、HbA1c および空腹時血漿グルコース (FPG) の統計的に有意な改善をもたらしました (表 8)。メトホルミンの投与量が一定に保たれたこの研究では、プランディンとメトホルミンの併用療法は、プランディンに関して用量節約効果を示しました。併用群の HbA1c および FPG の改善は、PRANDIN 単独療法群よりも低い 1 日あたりの PRANDIN 0.5 mg 投与量で達成されました (表 8)。
ピオグリタゾンとの併用でプランディン1mg
スルホニル尿素またはメトホルミンの単剤療法 (HbA1c > 7.0%)。プランディン 1mg の投与量は、最初の 12 週間で滴定され、その後 12 週間の維持期間が続きました。併用療法は、単独療法と比較して、統計的に有意な HbA1c および FPG の改善をもたらしました (図 1)。完了者の FPG (mg/dL) と HbA1c (%) のそれぞれのベースラインからの変化は、PRANDIN で -39.8 mg/dL と -0.1%、ピオグリタゾンで -35.3 mg/dL と -0.1%、および -92.4 mg/dL でした。組み合わせで dL と -1.9%。ピオグリタゾンの投与量が一定に保たれたこの研究では、併用療法グループは PRANDIN に関して用量節約効果を示しました (図 1 凡例を参照)。併用群の HbA1c と FPG の改善は、PRANDIN 単独療法群よりも低い 1 日あたりの PRANDIN 投与量で達成されました。
図 1: PRANDIN とピオグリタゾンの併用: HbA1c 値
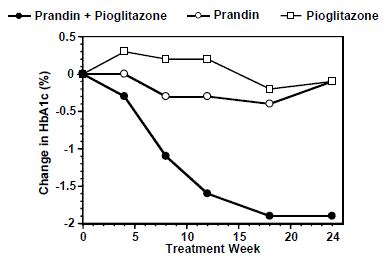
伝説
研究を完了した患者の研究週ごとの HbA1c 値 (組み合わせ、N = 101; PRANDIN 1mg、N = 35、ピオグリタゾン、N = 26)。 FPG が 270 mg/dL を超える被験者は、研究から除外されました。
ピオグリタゾンの用量: 30 mg/日で固定。 PRANDIN 1mgの最終用量の中央値:併用療法では6mg/日、単剤療法では10mg/日。
ロシグリタゾンとの併用でのプランディン
PRANDIN とロシグリタゾンの併用療法レジメンは、以前にスルホニル尿素またはメトホルミンで治療された 252 人の患者 (HbA1c > 7.0%) を登録した 24 週間の試験で、いずれかの薬剤単独による単剤療法と比較されました。併用療法は、単独療法と比較して HbA1c および FPG の統計的に有意な改善をもたらしました (以下の表 9)。併用療法の血糖効果は、1日あたりのPRANDIN 1mgの総投与量および1日あたりのロシグリタゾンの総投与量の両方に関して、用量節約的であった(表9の凡例を参照)。併用療法グループの HbA1c および FPG の改善は、それぞれの単独療法グループと比較して、PRANDIN 1mg およびロシグリタゾンのより低い 1 日用量で達成されました。
患者情報
低血糖症
PRANDIN 2mgが低血糖を引き起こす可能性があることを患者に知らせ、患者とその介護者に、グルコースモニタリングや低血糖の管理を含む自己管理手順について指示してください.低血糖の結果、集中力と反応力が損なわれる可能性があることを患者に知らせてください。低血糖のリスクが高い患者および低血糖の自覚症状が低下している患者では、血糖モニタリングの頻度を増やすことが推奨される[参照 警告と注意事項 ]。
管理
食事の30分前にPRANDIN 0.5mgを服用するように患者に指示してください。食事を抜くときは、プランディンの服用を控えるように患者に指示する[参照 投薬と管理 ]。
薬物相互作用
潜在的な薬物相互作用について患者と話し合い、PRANDIN との薬物間相互作用の可能性について知らせる [参照 薬物相互作用 ]。

